
| 0.8g |
| 32g/mol |
| 3.1g |
| 7.0g |
| 3.1g |
| 62g/mol |
| 40g/mol×0.2mol |
| 100g |


科目:高中化学 来源: 题型:
| A、AgCl沉淀的生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


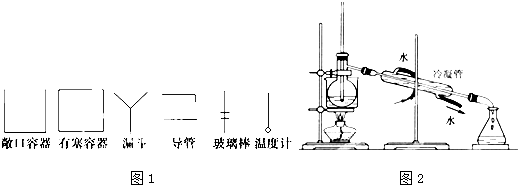
查看答案和解析>>
科目:高中化学 来源: 题型:
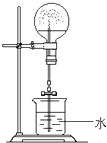 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
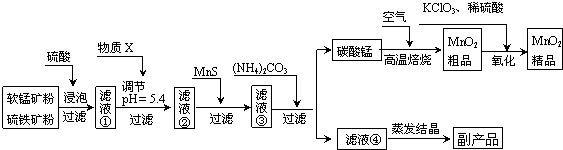
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com