
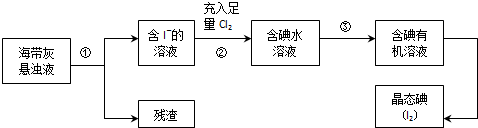
分析 海带灰悬浊液过滤得到含I-的溶液,溶液中充入足量的氯气氧化碘离子为碘单质,加入萃取剂萃取分液得到含碘有机溶液,蒸馏得到碘单质,
(1)根据仪器的作用选取仪器,灼烧用坩埚,转移坩埚用坩埚钳,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热;
(2)过滤后的滤液中含碘离子,充入足量Cl2可以被氧化为碘单质;
(3)萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,溶质和萃取剂不反应,萃取剂和原来溶剂不能互溶;
(4)a.不打开活塞,液体在大气压作用下无法流出;
b.上层液体从上口倒出,下层液体从下口流出;
(5)根据碘单质遇到淀粉会变蓝色来检验是否还有碘单质;
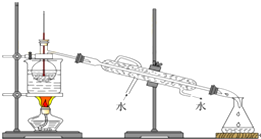
(6)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,大面积加热玻璃仪器需要垫石棉网;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
解答 解:(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台或三脚架、泥三角、酒精灯,用坩埚钳转移坩埚,无需使用烧杯,
故答案为:ABCDE;
(2)步骤②用氯气置换碘离子,其反应离子方程式为Cl2+2I-=I2+2Cl-;
故答案为:使I-转化为I2,Cl2+2I-=I2+2Cl-;
(3)碘在萃取剂CCl中的溶解度大于在原溶剂水中的溶解度,碘和四氯化碳不反应,四氯化碳和水不能互溶,所以可以用四氯化碳作萃取剂,
故答案为:CCl4;
(4)a.不打开活塞,液体在大气压作用下无法流出,
故答案为:保持分液漏斗内外压力平衡,使液体易于流下;
b.上层液体从上口倒出,下层液体从下口流出;CCl4 的密度大于水的密度,故从漏斗下口流出,
故答案为:漏斗下口;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘),
故答案为:淀粉溶液;
(6)冷凝水应是下进上出,温度计测量蒸气的温度,温度计水银球应与烧瓶支管口相平,烧杯加热需要垫石棉网,其错误有3处,
故答案为:3;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:受热比较均匀,温度容易控制;
点评 本题考查了海水资源的综合利用,为高频考点,涉及知识点较多,把握实验流程及发生的反应、萃取剂的选取标准、蒸馏实验原理及装置等知识点为解答的关键,侧重高频考点的考查,题目难度中等.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料中不含任何化学物质 | |
| B. | 没有水就没有生命 | |
| C. | 这种口服液含丰富的氮、磷、锌等微量元素 | |
| D. | 这种蒸馏水绝对纯净,其中不含任何离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com