
分析 pH=-lgc(H+),根据氢离子的物质的量相等计算稀释后溶液中氢离子浓度,再计算溶液的PH.
解答 解:10mLpH=4的盐酸,稀释10倍到100mL时,溶液体积增大10倍,则氢离子浓度减小为原来的$\frac{1}{10}$,所以其pH增大1,溶液pH为5,加水稀释到1000mL时,溶液体积增大100倍,则氢离子浓度减小为原来的$\frac{1}{100}$,所以其pH增大2,溶液pH为6,稀释104倍到10000L时,溶液接近中性,则c(H+)≈10-7 mol/L,溶液pH接近7并小于7,
故答案为:5;6;接近7并小于7.
点评 本题考查了pH的简单计算,先计算溶液中氢离子浓度,再根据PH公式进行计算,注意酸无论如何稀释都不能变为中性或碱性,为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)>v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 560mL | B. | 1120mL | C. | 0.1g | D. | 0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
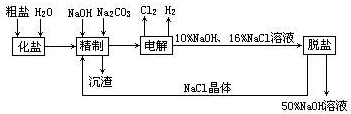
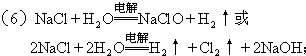 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究温度对产率的影响 实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | 4:1 | |
| ④ | 398 | 4 | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com