
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.此酸的电离平衡常数约为1×10-7
C.升高温度,溶液的pH增大
D.由HA 电离出的c(H+) 约为水电离出的c(H+) 的106倍
约为水电离出的c(H+) 的106倍
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g)  C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v (B)正=2 v (C)逆 B.容器内每消耗1 molD,同时生成1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:实验题
化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。
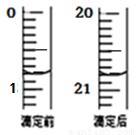
(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
稀氨水中存在着下列平衡:NH3 • H20 NH4 +0H ,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)( )
NH4 +0H ,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)( )
①NH4C1 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热 ⑥加入少量 MgS04 固体
A.仅①②③⑤ B. 仅③⑥ C. 仅③ D. 仅③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:实验题
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液)。
实验步骤:
A.用滴定管量取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液。
B.用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中,并滴加酚酞指示剂待用。
C.碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
D.滴定,并记录NaOH的终读数。重复滴定2-3次。
E.实验数据记录
1 | 2 | 3 | 4 | |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
(1)则c(样品)/moL•L-1=_________;样品总酸量=_________g/100mL。
(2)判断D步骤操作时溶液到达滴定终点的方法是________________。
(3)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是_________(填“无影响”、“偏大”或“偏小”,下同);若在D步骤用碱式滴定管时开始没有气泡,后产生气泡,则对滴定结果产生的影响是___________;若D步骤滴定前平视读数,滴定终点时俯视读数 ,则对滴定结果产生的影响是__________。
,则对滴定结果产生的影响是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH为( )
A.7.2 B.8 C.6 D.无法计算
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
已知:Fe2O3(s)+3/2C(s)=3/2CO2(g)+2Fe(s) △H=+234.1 kJ/mol;
C(s)+O2(g)=CO2(g)△H= -393.5 kJ/mol
则2Fe(s)+3/2O2(g )=Fe2O3(s)的△H值是( )
)=Fe2O3(s)的△H值是( )
A.-824.4 kJ/mol  B.-627.6 kJ/mo
B.-627.6 kJ/mo l
l
C.-744.7 kJ/mol D.-169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三上学期一检化学试卷(解析版) 题型:简答题
醋酸由于成本较低,在生产中被广泛应用。
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H= - 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H= - 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度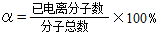 )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
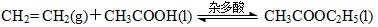
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
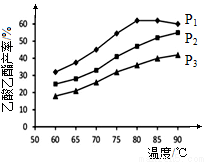
温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用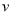 (P1)、
(P1)、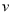 (P2)、
(P2)、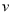 (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3— 离子中的两种组成,可以发生如图转化,下列说法正确的是( )

A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.在甲中滴加丁开始反应的离子方程式HCO3—+ Ba2++OH—= BaCO3↓+ H2O
D.白色沉淀A可能溶解在溶液D中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com