
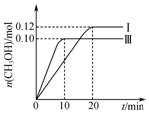
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |
分析 A.在前20 min内,容器Ⅰ中反应中甲醇物质的量0.12mol,反应的氢气物质的量为0.24mol,反应速率v=$\frac{△c}{△t}$;
B.计算反应T1时Ⅰ反应的平衡常数,计算浓度商和平衡常数比较判断平衡进行的方向;
C.容器ⅡCO(g)+2H2(g)?CH3OH(g),相当于起始量CO物质的量0.4mol,H2物质的量0.8mol,和容器Ⅰ相比起始量增大一倍,压强增大平衡正向进行;
D.容器Ⅲ达到平衡状态,甲醇物质的量为0.10mol,CO转化率=$\frac{0.10mol}{0.20mol}$×100%=50%,将容器Ⅲ改为绝热容器,实验起始温度为T2,反应为放热反应,温度升高平衡逆向进行.
解答 解:A.在前20 min内,容器Ⅰ中反应中甲醇物质的量0.12mol,反应的氢气物质的量为0.24mol,反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.24mol}{2.0L}}{20min}$=0.006mol/(L•min),故A错误;
B.计算反应T1时Ⅰ反应的平衡常数,
CO(g)+2H2(g)?CH3OH(g),
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.06 0.12 0.06
平衡量(mol/L) 0.04 0.08 0.06
K=$\frac{0.06}{0.04×0.0{8}^{2}}$=234.375
容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,CO浓度为(0.04+0.1)mol/L=0.14mol/L,CH3OH浓度(0.06+0.1)mol/L=0.16mol/L,
计算浓度商和Qc=$\frac{0.16}{0.14×0.0{8}^{2}}$=178.6<K,平衡进行的方向是正向进行,v(正)>v(逆),故B正确;
C.容器Ⅱ中CO(g)+2H2(g)?CH3OH(g),相当于起始量CO物质的量0.4mol,H2物质的量0.8mol,和容器Ⅰ相比起始量增大一倍,压强增大平衡正向进行,达到平衡时,容器Ⅱ中的压强一定小于容器Ⅰ中的压强的两倍,故C错误;
D.容器Ⅲ达到平衡状态,甲醇物质的量为0.10mol,CO转化率=$\frac{0.10mol}{0.20mol}$×100%=50%,将容器Ⅲ改为绝热容器,实验起始温度为T2,反应为放热反应,温度升高平衡逆向进行,CO的转化率小于50%,故D正确;
故选BD.
点评 本题考查了好像平衡影响因素、化学反应速率和平衡常数的计算、注意平衡条件的分析判断,掌握基础是解题关键,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
 X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:Z>R>W>Y | |
| B. | Y、Z、W 三种元素组成的化合物的水溶液可能显碱性 | |
| C. | Z 与 Y、Z 与 W 形成的化合物的化学键完全相同 | |
| D. | WY2、Y3 等可作为新的自来水消毒剂替代 W2,主要原因是 WY2、Y3 的氧化性比 W2 更强 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示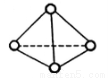 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
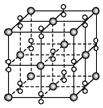
| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 每个晶胞含有4个Ba2+和4个O2- | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com