
【题目】下列化合物中,人体细胞中不可能存在的是
A. 葡萄糖 B. 纤维素 C. 氨基酸 D. 脂肪
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3﹣+2H2O ![]() 4ClO2↑+O2↑+4OH﹣ . 下列说法正确的是( )
4ClO2↑+O2↑+4OH﹣ . 下列说法正确的是( )
A.电解过程中OH﹣向阴极迁移
B.阳极反应式为:4OH﹣﹣4e﹣=O2↑+2H2O
C.毎有l mol电子转移,生成标准状况下5.6L气体
D.电解过程中阴极区溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH=CHCl可发生的反应有:①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性高锰酸钾溶液褪色 ⑥与AgNO3溶液反应得到白色沉淀
⑦聚合反应,正确的是( )
A. 只有⑥不能发生 B. 只有⑦不能发生
C. 只有②不能发生 D. 以上反应均可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写:
(1)含有12个氢原子的烷烃分子式__________________。其同分异构体共有________种;
(2)除去乙酸乙酯中含有的少量乙酸可用____________(填试剂名称);
(3)己烯、乙酸和葡萄糖组成的混合物中,氧元素的质量分数是32%,则氢元素的质量分数为__________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活,绿色出行”已经成为很多人的生活理念。CO2的捕捉和利用也成为了科学家们积极探索的热门领域。回答下列问题:
(1)用CO2催化加氢可制取乙烯,其能量关系如图1,写出该反应的热化学方程式____________。

(2)以硫酸作电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图2。则A为电池的___极,N极的电极反应式为_________________________。
(3)用CO2催化加氢制取二甲醚的反应为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在恒容密闭容器中,均充入2mol.CO2和6molH2,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率a(CO2)随反应温度的变化情况如图3。

①用Ir和Ce作催化剂时,反应的活化能更低的是_______。
②a、b、c、d和e五种状态,反应一定达到平衡状态的是__________,反应的△H ___0(填“>”、“=”或“<”)。
③从状态a到c,CO2转化率不断增大的原因是________________________________。
④状态e时,a(CO2)= 50%,若保持容器容积为10L,则此时的平衡常数K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于淀粉和纤维素的下列叙述中不正确的是( )
A. 互为同分异构体 B. 化学性质不相同
C. 碳、氢、氧元素的质量比相同 D. 属于同一类有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关第VI A族元素氧、硫、硒的说法正确的是
A.氧、硫、硒三种元索的最高正化合价均为+6B.氢化物的稳定性:H2O>H2S>H2Se
C.氢化物的还原性:H2O>H2S>H2SeD.单质的熔点:O2>S>Se
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-) 变化的关系如图所示。下列叙述错误的是

下列叙述错误的是
A. Kb1(N2H4)=10-6
B. 反应N2H62++N2H4=2N2H5+的PK=9.0 (已知:pK=-1gK)
C. N2H5C1溶液中c(H+)>c(OH-)
D. N2H5C1溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O主要用于制造船底防污漆,它是一种鲜红色粉末,几乎不溶于水,在湿空气中逐渐氧化成黑色氧化铜。用含NaOH的Na2SO3溶液还原CuSO4制备Cu2O的工艺流程如下:

回答下列问题:
(1)流程中涉及的化学反应主要包括:
Ⅰ.Cu2++2OH-=Cu(OH)2↓;Ⅱ.生成CuOH;Ⅲ.2CuOH=Cu2O+H2O。
写出第Ⅱ步反应的离子方程式: ______________________________。
(2)其他反应条件相同时,测得反应时间和溶液的pH对Cu2O产率的影响如下图所示:
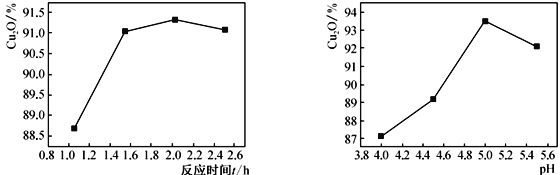
①反应时间超过2h时,Cu2O产率开始降低其原因是____________________________。
②pH<5时,Cu2O产率随pH减小而减小,产品中铜含量增加明显,其原因是______________________(用离子方程式说明)。
(3)为测定产品中Cu2O的含量,称取3.96 g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,至终点时消耗50mL标准液。
①滴定时应选用______(填“酸式”或“碱式”)滴定管,滴定终点的现象是______________________。
②产品与硫酸酸化的Fe2(SO4)3溶液反应的离子方程式为________________________________。
③假定杂质不参与反应,产品中Cu2O的质量分数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com