
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |
分析 元素的非金属性越强,其单质的氧化性越强,其氢化物的稳定性越强,其单质与氢气越容易化合,其最高价氧化物的水化物酸性越强,据此分析解答.
解答 解:A.元素的非金属性强弱与其最高正化合价无关,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,与其氢化物水溶液酸性强弱无关,故B错误;
C.元素的非金属性越强,其单质的氧化性越强,H2S能被Cl2氧化成硫单质,说明氧化性氯气大于S,则能证明非金属性Cl大于S,故C正确;
D.元素的非金属性越强,其最高价的水化物酸性越强,HClO不是Cl元素的最高价氧化物的水化物,则该选项不能证明非金属性强弱,故D错误;
故选C.
点评 本题考查非金属性强弱判断,为高频考点,非金属性强弱与得电子难易程度有关,与得电子多少无关,与其元素最高化合价及氢化物水溶液酸性强弱无关,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 2s | B. | 5 s | C. | 10 s | D. | 20 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金 | B. | 铁 | C. | 锰 | D. | 炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
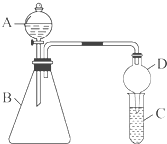 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A |  | 1,5-二甲基-3-乙基苯 |
| B |  | 异戊二烯 |
| C |  | 2,5-二甲基-5-庚醇 |
| D | CH3 CH2CH2(C2H5)CHCH(CH3)2 | 2-甲基-3-正丙基戊烷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NO2→HNO3 | B. | Fe→FeCl3→FeCl2 | ||
| C. | S→SO3→Na2SO4 | D. | Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
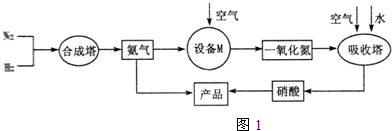
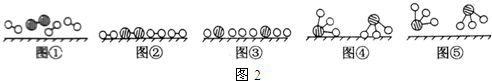
 、
、 、
、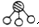 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com