
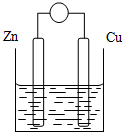
 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
分析 利用置换反应Zn+H2SO4=ZnSO4+H2↑,设计原电池,锌为负极,铜为正极,工作时,正极发生还原反应:2H++2e-=H2↑,负极发生氧化反应:Zn-2e-=Zn2+,Zn逐渐溶解,在外电路,电子从负极锌流出经导线流向正极铜,在内电路,电解质溶液中阴离子移向负极,阳离子移向正极,据此分析解答.
解答 解:(1)原电池是将化学能转化为电能的装置,利用置换反应Zn+H2SO4=ZnSO4+H2↑,设计原电池,锌为负极,铜为正极,工作时,正极发生还原反应:2H++2e-=H2↑,负极发生氧化反应:Zn-2e-=Zn2+,
故答案为:
| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | 铜 | 2H++2e-=H2↑ | 还原反应 |
| 负极 | 锌 | Zn-2e-=Zn2+ | 氧化反应 |
| 总反应式 | Zn+2H+=Zn2++H2↑ | 氧化还原反应 | |
点评 本题考查原电池工作原理,为高频考点,失电子发生氧化反应的金属作负极,在正极得电子发生还原反应的电解质溶液中的离子,正极材料不参加反应,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | ①→④→③→② | B. | ①→③→②→④ | C. | ①→②→③→④ | D. | ①→③→④→② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种情况下的正极反应都为O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解质溶液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| C. | 以NaOH溶液为电解质溶液时,电池工作过程中电解质溶液的碱性保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{{ρ_1}+{ρ_2}}}{2}$ | B. | $\frac{30.0%+20.0%}{2}$ | C. | 小于25.0% | D. | 大于25.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com