
【题目】小苏打的化学式是( )
A.Na2CO3B.NaHCO3C.NaOHD.Na2O
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是( )
实验目的 | 实验方案 | |
A | 检验FeSO4晶体是否已氧化变质 | 将FeSO4样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
B | 探究浓度对化学反应速率的影响 | 取两支试管,各加入4mL0.5mol/L的KMnO4酸性溶液,然后向两支试管中分别加入2mL0.1mol/LH2C2O4(草酸)溶液和2mL0.2mol/LH2C2O4溶液比较反应褪色的快慢 |
C | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相中的水 |
D | 判断淀粉是否水解 | 向用稀硫酸作催化剂的淀粉水解液中加入适量银氨溶液后水浴加热,观察是否产生银镜 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素中,基态原子的价层电子排布式不正确的是( )
A. As 4s24p3 B. Cr 3d44s2 C. Ga 4s24p1 D. Ni 3d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是铝箔在氧气中燃烧的实验,请回答下列问题:
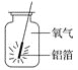
(1)铝在氧气中燃烧的化学方程式为______________________。
(2)实验时要在铝箔上系上一根火柴,其作用是______________________。
(3)集气瓶底部铺上一层细沙,其作用是______________________。
(4)实验中应观察到的现象是______________________________。
(5)用正确方法引燃铝箔,伸入装有氧气的集气瓶中后,未观察到铝箔剧烈燃烧的现象,可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物在生产生活和科学实验中应用广泛:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g)的△H=________。
2Fe(s)+3CO(g)+6H2(g)的△H=________。
②若该反应在5L的密闭容器中进行,5min后达到平衡,测得体系中固体质量减少0.96g,则该段时间内CO的平均反应速率为________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是________(选填序号)。
a.c(CH2)=c(CO) b.固体的总质量不变
c.v(CO)与v(H2)的比值不变 d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。

试用平衡移动原理解释该曲线的变化规律________________。若700℃时测得平衡时,H2浓度为1.0mol·L-1,则CH4的平衡转化率为_________。
(2)菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为________________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_______________________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,写出阳极的电极反应式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向H2C2O4溶液中逐滴滴加NaOH溶液,若定义pc=-lgc,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. 常溫下,Ka1(H2C2O4)=10-1.3
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. M点时,c(Na+)<2c(HC2O4-)+c(C2O42-)
D. ![]() 随pH的升高而增大
随pH的升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V mL硫酸铝溶液中含Al3+a g,取V/4 mL溶液稀释到4V mL,稀释后溶液中SO42-的物质的量浓度是
A. 125a/9V mol/L B. 125a/18V mol/L
C. 125a/36V mol/L D. 125a/54V mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com