
分析 (1)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,根据离子方程式的书写方法来书写;使SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl3,说明反应产生了抑制铝离子水解的氯化氢,根据化合价不变写出反应方程式;
(2)红热的铁能与水蒸气发生反应,生成Fe3O4和一种可燃性气体,可燃气体为氢气;黑色的物质溶于酸后,加入KSCN,见不到血红色产生,说明溶液中无亚铁离子,可能是黑色固体物质中含有单质铁,或者溶于还原性的酸;铝热反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)钠的化合物中纯碱是强碱弱酸盐,碳酸钠水解而使溶液呈碱性;向饱和的纯碱溶于中通入过量的二氧化碳反应生成碳酸氢钠.
解答 解:(1)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;使SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl3,说明反应中产生了抑制铝离子水解的氯化氢,该反应中元素化合价不变,则生成、氯化铝、二氧化硫和氯化氢气体,所以SOCl2与AlCl3•6H2O混合加热发生反应的化学方程式:6SOCl2+AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$12HCl+6SO2↑+AlCl3,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;6SOCl2+AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$12HCl+6SO2↑+AlCl3;
(2)红热的铁能与水蒸气发生反应,生成Fe3O4和氢气,反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,黑色的物质溶于酸后,加入KSCN,见不到血红色产生,说明溶液中无亚铁离子,可能是黑色固体物质中含有单质铁,或者溶于还原性的酸,反应方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2Fe3+=3Fe2+,或者Fe3O4+8H++2I-=3Fe2++4H2O+I2,铝热反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2Fe3+=3Fe2+;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)纯碱是强碱弱酸盐,在纯碱溶液中CO32-易水解生成氢氧根离子:CO32-+H2O?HCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,反应生成碳酸氢钠,离子反应为CO2+H2O+2Na++CO32-=2NaHCO3↓,
故答案为:CO32-+H2O?HCO3-+OH-,CO2+H2O+2Na++CO32-=2NaHCO3↓.
点评 本题考查了盐的水解原理及其应用,注意掌握盐的水解原理及影响因素,铝热反应,氧化还原反应,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
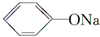 +CH3I→
+CH3I→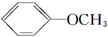 +NaI
+NaI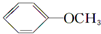 +HI→
+HI→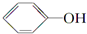 +CH3l
+CH3l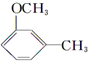 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$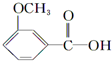
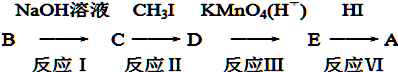
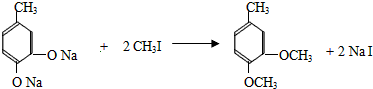 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 2甲基戊烷的沸点高于己烷 | |
| D. | 用水可区分苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A组 | B组 |
| Ⅰ.H-I键的键能大于H-Cl键的键能 Ⅱ.H-I键的键能小于H-Cl键的键能 Ⅲ.H-I键的键能小于H-Cl键的键能 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HCl比HI稳定 ③HI沸点比HCl低 ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4鉴别溴水和碘水 | |
| B. | 用AgNO3溶液鉴别溴化钾溶液和氯化钠溶液 | |
| C. | 向某盐溶液中加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,溶液中一定有NH4+ | |
| D. | 向某盐溶液中,加入盐酸,产生使澄清石灰水变浑浊的气体,溶液中含有大量CO32-离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com