
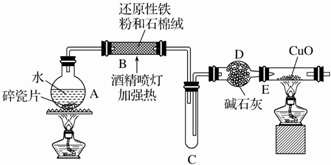
分析 由图可知,A中加热提供水蒸气,在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,C为缓冲装置,D中干燥管干燥氢气,E为氢气还原氧化铜的装置,以此来解答.
【探究一】(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,给液体加热时容易发生暴沸现象,加入碎瓷片可防止暴沸;
(2)装置E中氧化铜与氢气在加热的条件下反应生成铜和水,据此写出反应的化学方程式;氢气还原黑色的氧化铜,反应生成红色的铜单质和水;
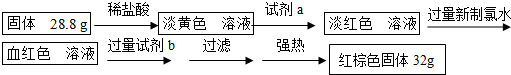
【探究二】(3)(4)在验证反应后黑色固体的成分时,检验Fe3+,最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+,可用酸性KMnO4溶液;
【探究三】(5)加入新制氯水,氯气氧化亚铁离子;
(6)由“红棕色固体”知,该物质为Fe2O3,反应转化关系为:FeCl3$\stackrel{NaOH}{→}$Fe(OH)3和NaCl,则试剂b为NaOH溶液;
(7)氧化铁的质量为:m(Fe2O3)=32g,根据n=$\frac{m}{M}$计算出氧化铁的物质的量,再根据铁元素守恒计算出铁的物质的量、质量,最后计算出反应后B装置中铁元素的质量分数.
解答 解:【探究一】(1)A中铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,液体加热时容易发生暴沸现象,碎瓷片多孔,加入碎瓷片引入沸点中心,其作用是防止暴沸,
故答案为:防止暴沸;
(2)装置E中氧化铜与氢气在加热的条件下反应生成铜和水,反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,则反应现象是:黑色粉末变成红色,且玻璃管上有水珠生成,
故答案为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;黑色粉末变成红色,且玻璃管上有水珠生成;
【探究二】(3)一份滴加几滴KSCN溶液,若溶液变血红色,说明溶液中含有铁离子,则可推断硬质玻璃管B中固体物质的成分为:①一定有Fe3O4;
若溶液未变血红色,则溶液中不存在铁离子,可推断硬质玻璃管B中固体物质中一定存在Fe,即②正确,
故答案为:①;②;
(4)亚铁离子与酸性高锰酸钾溶液反应:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,若酸性高锰酸钾溶液褪色,则证明溶液中含有亚铁离子,
故答案为:酸性KMnO4溶液;
【探究三】(5)氯气具有氧化性,能氧化亚铁离子,反应为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(6)由“红棕色固体”知,该物质为Fe2O3,则FeCl3$\stackrel{NaOH}{→}$Fe(OH)3和NaCl,过滤后加强热生成红棕色固体,则试剂b为NaOH溶液,
故答案为:NaOH;
(7)氧化铁的质量为:m(Fe2O3)=32g,则氧化铁的物质的量为:n(Fe2O3)=$\frac{32g}{160g/mol}$=0.2mol,则含有铁元素的物质的量为:n(Fe)=0.4mol,则反应后B装置中铁元素的质量分数为:$\frac{56g/mol×0.4mol}{28.8g}$×100%≈77.8%,
故答案为:77.8%.
点评 本题通过铁及其化合物性质考查了探究物质组成、测量物质含量的方法,题目难度中等,注意掌握探究实验的设计方法,明确铁及其化合物性质,试题涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、进行计算能力.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32- | B. | Ba2+、SO42-、Cl- | C. | K+、H+、OH- | D. | Ag+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的周期性变化 | B. | 电负性的周期性变化 | ||
| C. | 第一电离能的周期性变化 | D. | 原子核外电子排布的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
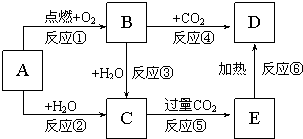 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质溴是一种红棕色液体 | B. | 溴水可使湿润的淀粉KI试纸变蓝 | ||
| C. | 单质碘易升华 | D. | 碘单质是从海水中大量提取的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都是生成CO2和H2O | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 我国从2008年6月1日,商家不得无偿提供塑料袋,目的是减少“白色污染” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com