
| A、原子半径:X>Y>Z>W |
| B、X和W可形成阴阳离子个数比为1:2的离子化合物 |
| C、X和Z形成的化合物在溶液中抑制水的电离 |
| D、向由X、Y和W三种元素形成的化合物的溶液中滴加盐酸,先有浑浊后变澄清 |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A、离子键就是使阴阳离子结合成化合物的静电引力 |
| B、大多数的盐、碱和低价金属氧化物中含有离子键 |
| C、只有金属元素和非金属元素化合时才能形成离子键 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b的 氢化物沸点高是因为分子中有氢键 |
| B、b、c、d三种元素可组成化学式为dcb2的化合物 |
| C、d单质在b单质中燃烧生成的化合物中阴阳离子个数比为1:2 |
| D、c的单质可用来制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 G的合成路线如图:
G的合成路线如图:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化氯(ClO2)是~种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:
二氧化氯(ClO2)是~种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

 为主要原料合成重要的化工产品
为主要原料合成重要的化工产品 .请你写出合成路线图,路线图用物质和箭头表示出来即可,示例如下:
.请你写出合成路线图,路线图用物质和箭头表示出来即可,示例如下: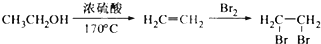
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心.试回答下列问题:
如图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ca2+、OH-、CO32- |
| B、NH4+、Br-、Na+、SO42- |
| C、Ag+、H+、SO32-、ClO- |
| D、H+、Cl-、Fe2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com