
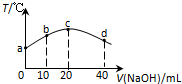
 常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 所加烧碱溶液PH=12,c点水的离子积常数KW=10-14 | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
分析 根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大;
B、水的离子积是温度的常数,温度不变水的离子积常数不变;
C、c点溶液中,n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,据此分析;
D、在d点溶液中,NaOH过量,溶液中n(NaOH)=n(NaNO2),根据电荷守恒和物料守恒来分析.
解答 解:根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;
B、水的离子积是温度的常数,温度不变水的离子积常数不变,c点的温度最高,所以c点水的离子积常数KW>10-14,故B错误;
C、c点溶液中,加入的氢氧化钠的物质的量n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,NO2-存在微弱的水解,溶液显碱性,故有:c(Na+)>c(NO2-)>c(OH-)>c(HNO2)>c(H+),故C正确;
D、在d点溶液中,NaOH过量,溶液中n(NaOH)=n(NaNO2),所以溶液中离子浓度大小为:c(Na+)>c(OH-)>c(NO2-)>c(H+),故D正确;
故选B.
点评 本题是根据图象分析离子的浓度之间的关系,解题的关键是根据图象中温度的变化来确定,确定物质的反应实质是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性H++Ba2++OH-+SO42-═BaSO4↓+H2O | |
| B. | 酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 钢铁腐蚀时可能发生的正极反应为:4OH-+4e-═2H2O+O2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 标准状况下气体的体积(mL) | 280 | 336 | 336 |
| A. | 甲、乙组的实验中,盐酸均是过量的 | B. | 盐酸的物质的量浓度为0.8mol L-1 | ||
| C. | 合金中镁、铝的物质的量之比为1:1 | D. | 丙组中铝的物质的量为0.0045mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
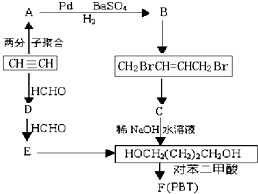 请根据以下知识解答
请根据以下知识解答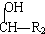 (R代表烃基,下同.)
(R代表烃基,下同.)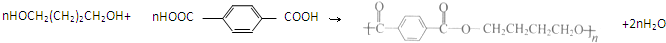 .
.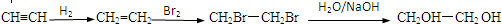 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )| A. | 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行 | |
| B. | a、b、c三点的平衡常数Kb>Kc>Ka | |
| C. | 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高 | |
| D. | a、b、c三点中,a点时SO2的转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
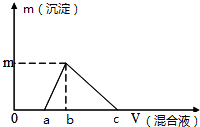 往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )| A. | a=25mL | B. | b=33mL | C. | c=100mL | D. | m=0.195g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1mol N2与足量H2混合反应生成NH3,转移电子数6NA | |
| B. | 在常温常压下,2.8g N2和CO的混合气体所含电子数为1.4NA | |
| C. | 标准状况下,22.4L CCl4含有的分子数目为NA | |
| D. | 在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质的水解产物是多种a-氨基酸 | |
| B. | 蛋白质溶液里加入饱和硫酸铵溶液,蛋白质会析出,且加水也不溶解 | |
| C. | 重金属盐能使蛋白质凝结,所以误食重金属盐会中毒 | |
| D. | 浓硝酸沾到皮肤上能使浓硝酸和蛋白质发生颜色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com