
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/mol· | 溶液的密度/g· | |
硫酸 |
|
|
氨水 |
|
|
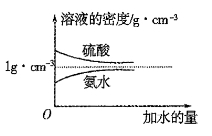
(1)表中硫酸的质量分数为 (用含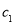 、
、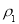 的代数式表示
的代数式表示 )。
)。
(2)物质的量浓度为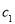 mol·
mol·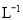 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 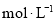 。
。
(3)物质的量浓度为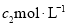 的氨水与
的氨水与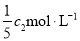 的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”下同)
的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”下同) ,所得溶液的物质的量浓度
,所得溶液的物质的量浓度 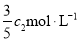 (设混合后溶液的体积变化忽略不计)。
(设混合后溶液的体积变化忽略不计)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷(解析版) 题型:填空题
(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
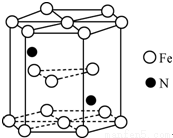
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二5月模块诊断化学试卷(解析版) 题型:选择题
常温常压下,将50mL三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原状态时,体积共减少了125 mL,则三种烃可能是
A.CH4、C2H2、C3H4 B.C2H6、C3H6、C4H6
C.C2H6、C3H6、C3H4 D.C2H4、C2H6、 C3H6
C3H6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:选择题
反应4A(s)+3B(g)  2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:选择题
以下化学用语正确的是
A.苯的最简式 C6H6
B.乙醇的分子式C2H6O
C.乙烯的结构简式CH2CH2
D. NH4Cl的电子式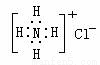
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A. 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理不同
B. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
C. 油脂的相对分子质量都较大,所以属于高分子化合物
D. 常温下分离乙酸和甲酸甲酯的混合物可以直接分液即可
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下期末化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是( )
A. X单质可以通过铝热法获得
B. Y的氧化物是良好的半导体材料
C. Z的氢化物比W的氢化物更稳定
D. X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末化学试卷(解析版) 题型:选择题
向容积固定为2L的密闭容器中充入9.6mol NO和4.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)ΔH<0
2NO2(g)ΔH<0
②2NO2(g) N2O4(g) ΔH<0
N2O4(g) ΔH<0
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是( )

A.前5min反应的平均速率v(NO)=0.24mol·(L·min)-1
B.T℃时反应①的化学平衡常数K=0.36
C.10min时改变反应条件可能是降低温度
D.若起始时向该容器中充入1.6m ol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同
ol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com