
����Ŀ��þ��ˮ��ʯ(þ�����ļ�ʽ̼����)�Ǿ��в�״�ṹ�������ܲ��ϣ�����Mg(NO3)2��6H2O��Fe(NO3)3��9H2O��CO(NH2)2�Ȱ�һ���������¶ȸ���90��ʱ��Ӧ�Ƶá�
(1)������������ʱ��n[CO(NH2)2]/n(Fe3+)��þ��ˮ��ʯ���ʺ���ҺpH�ı仯��ϵ��ͼ��ʾ��
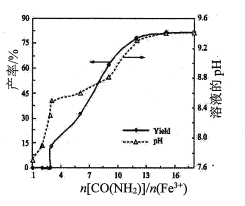
��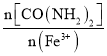 <3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
<3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
��n[CO(NH2)2]/n(Fe3+)>12����Һ��pH�����ȶ�״̬��������Ϊ_________________
(2)þ��ˮ��ʯ��ʾΪ��[FexMgy(OH)z](CO3)w��pH2O(Ħ������Ϊ660g��mol-1)����ͨ������ʵ�����������ȷ���仯ѧʽ���������£�
I��ȡþ��ˮ��ʯ3.300g��������ϡ�����ַ�Ӧ���ռ�������112mL(��״��)��
II�����ײ��þ��ˮ��ʯ�ȷֽ�TG-DSCͼ��303~473K��ʧȥ���ˮ(�ᾧˮ)ʧ��Ϊ10.9%��473~773Kʱ��CO32-��OH-�ֽ�ΪCO2��H2O��773K���ϲ���ΪMgO��Fe2O3��
��ȡ0.4000g�ȷֽ����(773K����)���ڵ���ƿ�У������Թ�������ʹ����ȫ�ܽ⣬��������ˮ���Թ�����KI��Һ���ڰ�������Ƭ�̣���0.1000mol��L-1Na2S2O3����Һ�ζ�����Һ�ʵ���ɫ������3mL������Һ�������ζ�����Һ��ɫ��ʧ��(2Na2S2O3+I2=2NaI+Na2S4O6)������Na2S2O3��Һ20.00mL��ͨ������ȷ��þ��ˮ��ʯ�Ļ�ѧʽ______________(д���������)��
���𰸡�CO2 ���ﵽ��Һƽ�⣬����Һ��OH��Ũ�ȴ��ڣ���������״̬ [Fe2Mg6(OH)16] CO3��4H2O
��������
(1)�ٸ���Ԫ���غ㣬�Լ�Ŀ������к���CO32������֪���û�а����ݳ������ݳ���������Ҫ��CO2��
�ڴ�ͼ�п��Կ�����n[CO(NH2)2]/n(Fe3+)>12ʱ���ⰱ�Ǽ����NH3����Ҳû�б仯������Һ���ݳ���NH3�������ܽ�����Һ��NH3����ͬ���ﵽ��ƽ��״̬����Һ��OH���ﵽ����״̬����Ϊ�����ﵽ��Һƽ�⣬����Һ��OH��Ũ�ȴ��ڣ���������״̬��
(2)��þ��ˮ��ʯ����������ϡ���ᣬ���е�CO32������H����Ӧ����CO2������112mL�����壬��Ʒ�����ʵ���![]() ������CO2�����ʵ���
������CO2�����ʵ���![]() ����w=
����w=![]() ��
��
����303��473K��þ��ˮ��ʯʧȥ�ᾧˮ��ʧ��Ϊ10.9%����p=![]() =4��
=4��
����2Fe3++2I��=I2+2Fe2+��2Na2S2O3+I2=2NaI+Na2S4O6���ù�ϵʽFe3+��Na2S2O3��n(Fe3+)=n(Na2S2O3)=0.1000mol��L��1��20.00mL��10��3L��mL��1=2.000��10��3mol��n(Fe2O3)=1.000��10��3mol���ȷֽ�����У�����Fe2O3��MgO����n(MgO)=![]() =6.000��10��3mol��
=6.000��10��3mol��
��þ��ˮ��ʯ��þ�����ı���Ϊ![]() =6.000��10��3mol��2.000��10��3mol=3��
=6.000��10��3mol��2.000��10��3mol=3��
�ɻ��ϼ۴�����Ϊ0��x��3+y��2+z��(��1)+1��(��2)=0��
��Ħ������Ϊ660g��mol��1��56g��mol��1��x+24g��mol��1��y+17g��mol��1��z+60g��mol��1��1+18g��mol��1��4=660g��mol��1��
���Խ�ã�x=2y=6z=16����þ��ˮ��ʯ��ѧʽΪ[Fe2Mg6(OH)16]CO3��4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ���ﵽƽ��: H2O![]() H��+ OH����H > 0 ������������ȷ����
H��+ OH����H > 0 ������������ȷ����
A. ��ˮ���ȣ�Kw����pH����
B. ��ˮ�м����������ᣬc(H+)����Kw����
C. ��ˮ�м���NaOH���壬ƽ�������ƶ���c(OH-) ����
D. ��ˮ�м���AlCl3���壬ƽ�������ƶ���c(OH-) ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȼ��2.9gij�л���A������8.8g������̼��4.5gˮ�������л�������������ܶ�����ͬ�����¿�����2����
��1������л���ķ���ʽ___________��
��2���ƶϸ��л�����״ͬ���칹��Ľṹ��ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ����
A.����ϡ���ᷴӦ��Fe +2H+ =2Fe2+ + H2��
B.����������Һ�����ᷴӦ��OH- + H+ = H2O
C.��������ͭ��Һ��Ӧ��2Na + Cu2+ = 2Na+ + Cu
D.�Ȼ�����Һ��ϡ���ᷴӦ��Ba2+ + SO![]() = BaSO4��
= BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
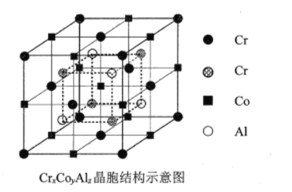
����Ŀ��Cr��Co��Al�ĺϽ�����ػ�������;�dz��㷺��
(1) Cr3+��̬��������Ų�ʽΪ___________��
(2)1951��Tsao���籨����LiAlH4��ԭ�棬�練Ӧ�� ��
��
��LiAlH4������Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ___________��
�� ������̼ԭ�ӵĹ���ӻ�����Ϊ__________��1mol�÷����к��Ҽ������ʵ���Ϊ__________��
������̼ԭ�ӵĹ���ӻ�����Ϊ__________��1mol�÷����к��Ҽ������ʵ���Ϊ__________��
(3) [Co(15-��-5)(H2O)2]2+��һ����λ����(��15-��-5����ָ���ѵĻ���ԭ������Ϊ15������Oԭ����Ϊ5)�����ڸ���λ���ӽṹʾ��ͼ(ͼ-1)�е���Ӧλ�ò�������λ��____________��
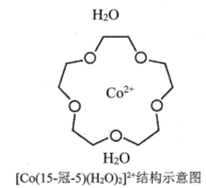 ͼ1
ͼ1
 ͼ2
ͼ2
(4)ȫ��˹�պϽ�CrxCoyAlz�ľ����ṹ����ͼ-2��ʾ�����仯ѧʽΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CS(NH2)2 (����)��һ�ְ�ɫ���壬139Cʱ �ܽ��Ϊ9.2g��(100gH2O)-1������������ҩ�Ⱦ�ϵȡ���H2NCN(�谱)��Na2S��Һ����ԭ�ϣ���Լ50��C��pH 10~11ʱ��ȡ��ʵ��װ��(�гּ�����װ������)���£�
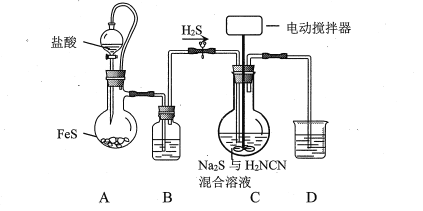
(1)װ��B��D��ʢ�ŵ��Լ��ֱ���__________�� _________��
(2)װ��C���ʵļ��ȷ�ʽ��___________��
(3)��ƿ��Na2S������ʵ�����H2NCN��Ӧ�Ļ�ѧ����ʽΪ_________________________________���Ժ��ʵ�����ͨ��H2S��Ŀ����_________________________��
(4)ʵ���������ִμ���H2NCN������ͨ��H2S��������ظ�ֱ��Һ���г�����״���ƺ��������Դ�װ��C�ķ�ӦҺ�з���õ����徧���ʵ�鷽����______________________[ʵ���б���ʹ�õ��Լ���NaOH��Һ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��л������Ŀ�����ʽC4H7ClO2������NaHCO3��Һ��Ӧ����CO2���л������Ŀ(�����������칹)��ͬ����
A.����ʽΪC5H10��ϩ��B.�ױ���һ�ȴ���
C.��Է�������Ϊ74��һԪ��D.������(![]() )�Ķ�����ȡ����
)�Ķ�����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���غ͵����ػ������ڻ���ҽҩ���ϵ������й㷺��Ӧ�á��ش���������:
��1����̬Kԭ���У������˶�״̬��ͬ�ĵ��ӹ�________�֣�ռ������ܼ��ĵ��ӵĵ���������ͼ��״Ϊ________��
��2��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ����һ�����ܱȽ�:K________(����>������<��)Cr,������ǿ�ȱȽ�:K________(����>������<")Cr.
��3��IO3-���ӵ����幹�͵�����Ϊ________������ԭ�ӵ��ӻ���ʽΪ________.
��4��HIO4������ǿ��HIO3,��ԭ��Ϊ________
��5��KIO3������һ���������õķ����Թ�ѧ���ϣ�������ͼ��
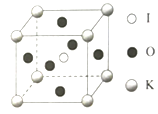
�������ⳤΪa=0.446nm,������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã�K��I�����̾���Ϊ________nm,��K���ڵ�O�ĸ���Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com