
·ÖĪö Ģś±ČĶ»īĘĆ£¬ÓėFeCl3ČÜŅŗ·“Ó¦Ź±ĻČŗó·¢ÉśFe+2Fe3+=3Fe2+”¢Cu+2Fe3+=Cu2++2Fe2+£¬ŌĀČ»ÆĢśČÜŅŗÖŠŗ¬ÓŠĀČ»ÆĢśµÄĪļÖŹµÄĮæĪŖn£ØFeCl3£©=5mol/L”Į0.1L=0.5mol£¬½įŗĻ·“Ó¦µÄ·½³ĢŹ½½ā“š£®
½ā“š ½ā£ŗĢśµÄ»¹ŌŠŌĒæÓŚĶ£¬°ŃĢś”¢Ķ»ģŗĻ·ŪÄ©¼ÓČėĀČ»ÆĢśČÜŅŗÖŠ£¬ĢśĻČÓėĢśĄė×Ó·“Ó¦£¬ĀČ»ÆĢśµÄĪļÖŹµÄĮæŹĒ0.5mol£¬
Éč0.5molĢśĄė×ÓĶźČ«·“Ó¦ĻūŗÄĢś”¢ĶµÄÖŹĮæ·Ö±šĪŖm1”¢m2£¬Ōņ£ŗ
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=$\frac{64g”Į0.5mol}{2mol}$=16g£¬
m2=$\frac{56g”Į0.5mol}{2mol}$=14g£¬
ČܽāµÄ½šŹōÖŹĮæĪŖ£ŗ18g-2.8g=15.2g£¬14g£¼15.2g£¼16g£¬
ŌņĢśĶźČ«·“Ó¦”¢Ķ²æ·Ö·“Ó¦£¬ĒŅFe3+ĶźČ«·“Ó¦£¬Ź£ÓąµÄ½šŹōĪŖCu£¬
£Ø1£©·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½Fe+2Fe3+=3Fe2+”¢Cu+2Fe3+=Cu2++2Fe2+£¬¹Ź“š°øĪŖ£ŗFe+2Fe3+=3Fe2+”¢Cu+2Fe3+=Cu2++2Fe2+£»
£Ø2£©·“Ó¦ŗóČÜŅŗÖŠĪŽFe3+£¬¼ģŃé·½·ØŹĒȔɣĮæ·“Ó¦ŗóµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓKSCNČÜŅŗ£¬²»ĻŌŃŖŗģÉ«£¬ŌņČÜŅŗĪŽFe3+£¬¹Ź“š°øĪŖ£ŗĪŽ£»Č”ÉŁĮæ·“Ó¦ŗóµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓKSCNČÜŅŗ£¬²»ĻŌŃŖŗģÉ«£¬ŌņČÜŅŗĪŽFe3+£»
£Ø3£©Éč·“Ó¦ĻūŗÄĶµÄĪļÖŹµÄĮæĪŖn1£¬·“Ó¦µÄĢśµÄĪļÖŹµÄĮæĪŖn2£¬
Ōņ£ŗ¢Ł64n1+56n2=15.2g
¢Śn1+n2=$\frac{1}{2}$n£ØFe3+£©=0.25mol£¬
½āµĆ£ŗn1=0.15mol”¢n2=0.1mol£¬
øł¾Ż·“Ó¦·½³ĢŹ½æÉÖŖ·“Ó¦ŗóČÜŅŗÖŠn£ØFe2+£©=2n£ØCu£©+3n£ØFe£©=2”Į0.15mol+3”Į0.10mol=0.6mol£¬
·“Ó¦ŗóČÜŅŗÖŠĶĄė×ÓµÄĪļÖŹµÄĮæĪŖn£ØCu2+£©=n£ØCu£©=0.15mol£¬
¹Źn£ØFe2+£©+n£ØCu2+£©=0.6mol+0.15mol=0.75mol£¬¹Ź“š°øĪŖ£ŗ0.75£»
£Ø4£©ŌĄ“»ģŗĻĪļÖŠŗ¬ÓŠµÄĶµÄÖŹĮæĪŖ£ŗ0.15mol”Į64g/mol+2.8g=12.4g£¬
“š£ŗCuµÄÖŹĮæĪŖ12.4g£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļµÄ¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬עŅāøł¾Ż·“Ó¦µÄĻą¹Ų·½³ĢŹ½“ÓÖŹĮæŹŲŗćµÄ½Ē¶Č½ā“š£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņNa2CO3ČÜŅŗÖŠĶØČėNH3£¬$\frac{c£ØN{a}^{+}£©}{c£ØC{{O}_{3}}^{2-}£©}$¼õŠ” | |
| B£® | ½«0.1mol•L-1µÄK2C2O4ČÜŅŗ“Ó25”ęÉżĪĀÖĮ35”ę£¬$\frac{c£Ø{K}^{+}£©}{c£Ø{C}_{2}{{O}_{4}}^{2-}£©}$Ōö“ó | |
| C£® | Ļņ0.1mol•L-1µÄHFČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮÖŠŠŌ£¬$\frac{c£ØN{a}^{+}£©}{c£Ø{F}^{-}£©}$=1 | |
| D£® | Ļņ0.1mol•L-1µÄCH3COONaČÜŅŗÖŠ¼ÓČėÉŁĮæĖ®£¬$\frac{c£ØC{H}_{3}COOH£©}{c£ØC{H}_{3}CO{O}^{-}£©•c£Ø{H}^{+}£©}$Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņijČÜŅŗÖŠ¼ÓČėĻõĖįŅųČÜŅŗ£¬°×É«³ĮµķÉś³É£¬Ö¤Ć÷ŌČÜŅŗŹĒŃĪĖį | |
| B£® | ĘųĢåĶعżĪŽĖ®CuSO4£¬·ŪÄ©±äĄ¶£¬Ö¤Ć÷ŌĘųĢåÖŠŗ¬ÓŠĖ®ÕōĘų | |
| C£® | ĻņijČÜŅŗÖŠ¼ÓÉŁĮæĀČ»Æ±µČÜŅŗ£¬Čō³öĻÖ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠŗ¬ÓŠSO42- | |
| D£® | ĻņijČÜŅŗÖŠ¼ÓČėÉŁĮæĻ”ŃĪĖį£¬²śÉśµÄĘųĢåÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņŌČÜŅŗŅ»¶Øŗ¬CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | 150L2mol•L-1NaClČÜŅŗ | B£® | 70.5L0.5mol•L-1CaCl2ČÜŅŗ | ||
| C£® | 150L2mol•L-1KClČÜŅŗ | D£® | 75L2mol•L-1AlCl3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| Ń”Ļī | ŹµŃéŹĀŹµ | ½įĀŪ |
| A | ½«SO2ĶØČėŗ¬HClOµÄČÜŅŗÖŠÉś³ÉH2SO4 | HClOµÄĖįŠŌ±ČH2SO4Ēæ |
| B | ĀĮ²ŌŚ¾Ę¾«µĘ»šŃęÉĻ¼ÓČČČŪ»Æµ«²»µĪĀä | ĀĮ²±ķĆęŃõ»ÆĀĮČŪµćøßÓŚĀĮ |
| C | SiO2æÉŅŌŗĶNaOHČÜŅŗ¼°HFČÜŅŗ·“Ó¦ | SiO2ŹōÓŚĮ½ŠŌŃõ»ÆĪļ |
| D | ½«SO2ĶØČėäåĖ®ÖŠ£¬äåĖ®ĶŹÉ« | SO2¾ßÓŠ»¹ŌŠŌ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆŹŖČóµÄĄ¶É«ŹÆČļŹŌÖ½¼ģŃé°±Ęų | |
| B£® | µ±ÅØ°±Ė®ÓėÅØĮņĖį·“Ó¦»į²śÉś°×ŃĢ | |
| C£® | Ö»ÓĆBaCl2ČÜŅŗ¾ĶæÉŅŌ¼ų±šSO42-ŗĶCO32- | |
| D£® | ŌŚ»ÆѧŹµŃéÖŠ£¬µćČ¼æÉČ¼ŠŌĘųĢå¾łŠčŅŖŃé“æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
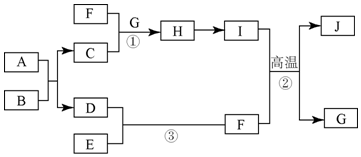
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com