
| A. | 稳定性:NH3>H2O>H2S | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:Mg(OH)2>Ca(OH)2>Ba(OH)2 |
分析 A.元素的非金属性越强,对应的氢化物越稳定;
B.元素的非金属性越强,其单质的氧化性越强;
C.元素的非金属性越强,其最高价氧化物的水合物的酸性越强;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.非金属性O>N>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2O>NH3>H2S,故A错误;
B.非金属性Cl>S>P,元素的非金属性越强,其单质的氧化性越强,故B正确;
C.非金属性Cl>S>P,元素的非金属性越强,其最高价氧化物的水合物的酸性越强,应为HClO4>H2SO4>H3PO4,故C错误;
D.金属性Ba>Ca>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,应为Ba(OH)2>Ca(OH)2>Mg(OH)2,故D错误.
故选B.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
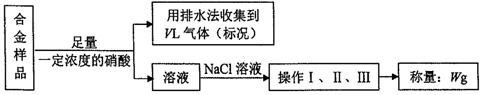
| A. | 铜、银都能与硝酸反应,收集到的VL气体全为NO | |
| B. | 操作I、II、III分别为过滤、洗涤、干燥 | |
| C. | 利用气体体积VL及样品质量mg可计算铜的质量分数 | |
| D. | 久置的银器变黑、铜绿的形成都发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验步骤 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 产生白色沉淀,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| D | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp (AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
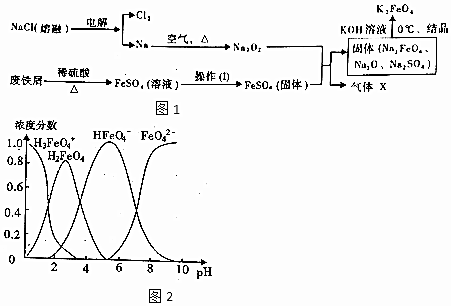
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com