
分析 燃烧0.5mol有机物A生成22g二氧化碳和18g水,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(H2O)=$\frac{18g}{18g/mol}$=1mol,可知有机物含有1molC,4molH,燃烧0.5mol有机物B生成二氧化碳、水的质量与A相同,可知B含有的C、H与A相同,结合耗氧量确定A、B的分子式和结构简式,以此解答该题.
解答 解:燃烧0.5mol有机物A生成22g二氧化碳和18g水,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(H2O)=$\frac{18g}{18g/mol}$=1mol,可知有机物含有1molC,4molH,燃烧0.5mol有机物B生成二氧化碳、水的质量与A相同,可知B含有的C、H与A相同,则A、B可能为CH4或CH4O,
0.5molA燃烧消耗氧气32g,即1mol,A应为CH4,发生CH4+O2→CO2+2H2O,
燃烧0.5mol有机物B生成二氧化碳、水的质量与A相同,但消耗氧气是24g,n(O2)=$\frac{24g}{32g/mol}$=0.75mol,B为CH4O,结构简式为CH3OH,发生CH4O+$\frac{3}{2}$O2→CO2+2H2O,
故答案为:CH4;CH4O;CH3OH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确有机物耗氧量为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
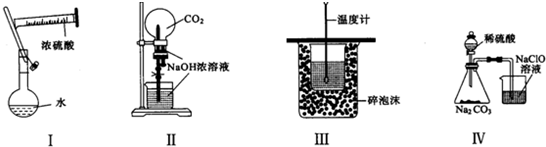
| A. | 实验Ⅰ:配制一定物质的量浓度的稀硫酸 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:验证酸性的强弱,H2SO4>H2CO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| C. | 元素X与氢形成的化合物可能既有极性键又有非极性键 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
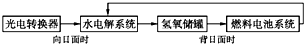 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )| A. | 该能量转化系统工作时,需不断补充H2O | |
| B. | 该转化系统的能量本质上来源于太阳能 | |
| C. | 水电解系统中的阴极反应:O2+2H2O+4e-═4OH- | |
| D. | 燃料电池放电时的负极反应:H2-2e-═2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=m+n | B. | a+b=m+n | C. | a-b=m-n | D. | a-b=m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com