
【题目】下列热化学方程式或离子方程式中,正确的是()
A.0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ·mol﹣1,则H2的燃烧热为571.6kJ·mol﹣1
D.CO(g)的燃烧热是283.0kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0kJ·mol﹣1
【答案】A
【解析】
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合,两种溶质的物质的量比之为1:2,反应生成硫酸钡、氢氧化铝和一水合氨,离子反应为NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O,故A正确;
B. 0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,反应为可逆反应,而热化学反应中为完全反应的能量变化,则N2(g)+3H2(g)![]() 2NH3(g)△H<﹣38.6kJ·mol﹣1,故B错误;
2NH3(g)△H<﹣38.6kJ·mol﹣1,故B错误;
C.燃烧热指的是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧必须生成液态水,故C错误;
D.CO(g)的燃烧热是283.0kJmol-1,为1molCO燃烧生成二氧化碳的能量变化,则CO2分解的热化学方程式为:CO2(g)=CO(g)+1/2O2(g)△H=+283.0kJ·mol﹣1,故D错误;
答案:A


科目:高中化学 来源: 题型:
【题目】25℃时,向10mL 0.01mol·L-1NaA溶液中逐滴加入0.01mol·L-1的盐酸,滴定曲线如图所示,下列表述不正确的是

A.图中的a点可能存在![]()
B.b点时,溶液中微粒浓度大小的关系:![]()
C.在c点的溶液中:![]()
D.d点溶液存在的关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。下列说法不正确的是( )

A.在0点时,醋酸没有电离
B.a、b、c三点,b点时醋酸溶液中氢离子浓度最大
C.a、b、c三点,c点时,醋酸电离程度最大
D.a、b、c三点,a点c(CH3COO-)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
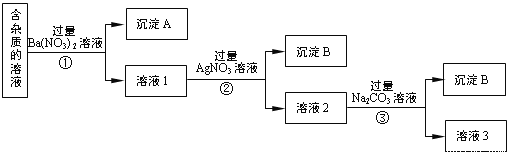
(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 molL-1的HNO3溶液,但是在实验室中只发现一瓶8 molL-1的HNO3溶液,该小组用8molL-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括________、_____mL量筒、烧杯、________、胶头滴管等。
②该实验中需要量取8molL-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取用8molL-1的HNO3溶液溶液时仰视量筒刻度线
B.量取用的量筒水洗后未进行任何操作
C.8molL-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯无水![]() 是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是
是电解法制镁的关键原料,有化工人员开发了以菱镁矿(主要成分是![]() ,含少量
,含少量![]() 杂质)为原料,以乙二醇为溶剂,采用氨络合法制备
杂质)为原料,以乙二醇为溶剂,采用氨络合法制备![]() (白色块状固体或粉末,溶于水,易潮解),再转化为无水
(白色块状固体或粉末,溶于水,易潮解),再转化为无水![]() 的新工艺,其流程图如图:
的新工艺,其流程图如图:
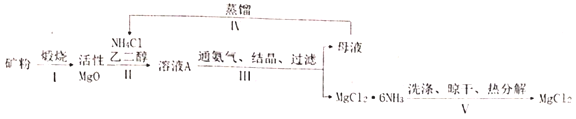
已知:①常压下,![]() 的初始分解温度为399℃,
的初始分解温度为399℃,![]() 的初始分解温度为896℃;
的初始分解温度为896℃;
②煅烧温度是影响MgO活性的关键因素;
③乙二醇的沸点197.3℃。
(1)步骤Ⅰ中工业上一般不选择800℃以上来完成这一步原因是_____。
(2)步骤Ⅱ中反应方程式为_____。
(3)步骤IV中蒸馏的目的是____。
(4)步骤V中的洗涤是为了除去晶体表面的杂质,最好选用下列哪种作为洗涤剂____。
A.氯化铵饱和溶液 B.乙二醇
C.冷水 D.氨气饱和的乙醇溶液
(5)实验过程需要测定![]() 浓度,可通过EDTA滴定(与
浓度,可通过EDTA滴定(与![]() 以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
以1:1反应)来进行测定,若分下列步骤(未按顺序排列),为获得更可靠的实验结果,完整的操作顺序是c→___→e(用操作步骤前的字母表示)。
a.移取25.00mL待测溶液于锥形瓶中,加入10mL水,摇匀
b.用0.1000mol/L的EDTA标准溶液滴定至终点,记录消耗标准液的体积
c.称取一定质量的样品,配制250mL待测溶液
d.滴加1-2滴指示剂
e.舍弃不可靠数据、取平均值等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )
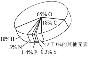
A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是( )
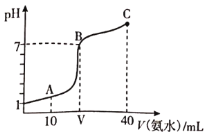
A. HA的电离方程式为![]()
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:![]()
D. C点所示溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:

请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。


(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com