
| A、①②③④⑤⑥⑦⑧ |
| B、①④⑤⑥⑦ |
| C、④⑤⑥⑦⑧ |
| D、③④⑤⑦⑧ |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
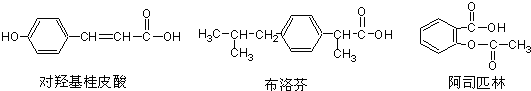
| A、三种有机物都能发生水解反应 |
| B、三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C、三种物质中,其中有两种互为同分异构体 |
| D、三种物质在一定条件下,均可以与H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
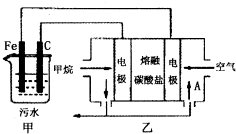 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
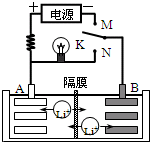 如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:A、该电池的反应式为Li1-xMnO2+LixC6
| |||
| B、K与M相接时,A是阳极,发生氧化反应 | |||
| C、K与N相接时,Li+由A极区迁移到B极区 | |||
| D、在整个充电或放电过程中都只存在一种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
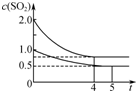 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.| A、热量:Q(甲)<2Q(乙) |
| B、压强:p(甲)<2p(乙) |
| C、乙中前5 min内的反应速率v(O2)=0.10 mol?L-1?min-1 |
| D、保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②⑤ |
| C、②④⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
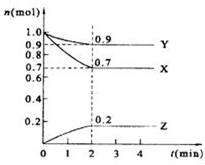 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com