
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
科目:高中化学 来源: 题型:填空题
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。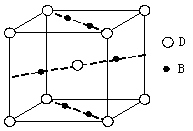
该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学—--选修3:物质结构与性质】(15分)
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为 ;
(2)Mn基态原子核外处在能量最高的能级上的电子共有 种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为 ;
② HCHO分子中C原子轨道的杂化类型为 ;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是
g(保留两位小数);阿伏加德罗常数为 (列式计算,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2 X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
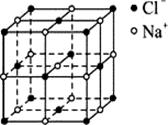
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) 类推法是科学学习的重要方法之一
⑴下列类推结论正确的是
| | 类比对象 | 结论 |
| A | Cl2+H2O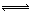 HCl+HClO HCl+HClO | I2+H2O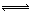 HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: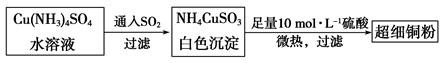
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②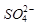 的空间构型为_____________,
的空间构型为_____________,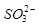 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 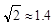 ,列式并计算结果)。
,列式并计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式 ;Z的氢化物结构式为 ;写出U元素在周期表中的位置 。
(2)原子半径:U V(填>、<或=,下同);气态氢化物的水溶液的酸性:U V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是 。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。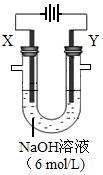
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com