选做题:(本包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.)
A.有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能级,且I
1(E)<I
1(T)<I
1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT
+2与ET
2互为等电子体.X为周期表前四周期中电负性最小的元素,Z的原子序数为28.
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT
+2的电子式
,基态Z原子的核外电子排布式
1s22s22p63s23p63d84s2
1s22s22p63s23p63d84s2
;
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有
这两种氢化物均为极性分子、相互之间能形成氢键
这两种氢化物均为极性分子、相互之间能形成氢键
等两种;
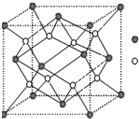
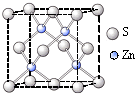
(3)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为
KO2
KO2
;
(4)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石.
①乙的晶体类型为
原子晶体
原子晶体
;
②乙的晶体中E、Q两种元素原子的杂化方式均为
SP3
SP3
.
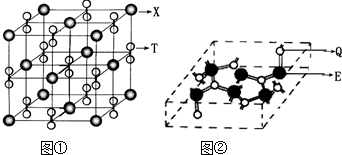
B.现有氧化铜和碳粉组成的混合物,为通过实验确定氧化铜的质量分数,某同学设计的实验方案中装置如下:
分析上述装置,回答下列问题:
(1)本实验中,酒精灯加热也可达到反应所需的温度,改用电热丝加热的优点是有利于
d
d
.
a.加快反应速率b.氢气流动
c.加热温度更高d.精确测定数据
(2)为确保能准确测定到必要的数据,下列步骤按实验操作顺序排列应为:
dcbea
dcbea
(填字母).
a.停止通氢气;b.电热丝通电;c.通入氢气;d.装置气密性检查;e.电热丝停止通电.
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称.若无需改进,则将装置图中虚线部分改为实线.
(4)实验结束后,该同学交给老师的实验报告主要栏目如图

(具体内容已略).请你根据实验报告的撰写要求,对此份报告作出评价,若有不完整,请在下面的空格中写出,若已完整,则无需填写.
实验名称(标题)、实验步骤(内容)
实验名称(标题)、实验步骤(内容)
.
(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案.请你用化学方程式来表示新方案的反应原理,并指出需要测定的数据:
化学方程式
CuO+H
2SO
4→CuSO
4+H
2O(或C+O
CO
2)
CuO+H
2SO
4→CuSO
4+H
2O(或C+O
CO
2)
;
需要测定的数据
样品的质量、C的质量(或CuO的质量)
样品的质量、C的质量(或CuO的质量)
.



 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]




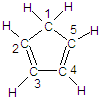 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是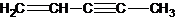 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有