
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、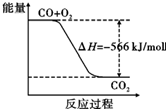 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
| 1 |
| 2 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的表面电镀上了一层耐磨的黄金 |
| B、环境污染日趋严重,它们表面的铜丝被酸雨溶解洗去 |
| C、铜的金属活动性比氢小,因此不易被氧化 |
| D、它们是含有一定比例的金、银、锡、锌的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、OH-、Cl- |
| B、Ba2+、Cu2+、NO3-、SO42- |
| C、Mg2+、Na+、OH-、SO42- |
| D、H+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4++H2O?NH3?H2O+H+ |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、S2-+H2O?HS-+OH- |
| D、NH3+H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水溶液中和熔化状态下能导电的化合物 |
| B、在水溶液中或熔化状态下能导电的物质 |
| C、在水溶液中或熔化状态下能导电的化合物 |
| D、在水溶液中或熔化状态下导电的离子由原物质本身电离出来的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
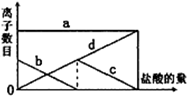 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com