


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
13 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| B、某物质在固态时能导电,可确认该物质是金属单质 |
| C、一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 |
| D、氧化物只可能是氧化产物,不可能是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
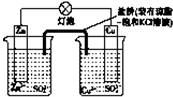
| A、负极反应为 Zn+2e-=Zn2+ |
| B、盐桥中的K+移向ZnSO4溶液 |
| C、在外电路中,电流从负极流向正极 |
| D、电池反应为 Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com