
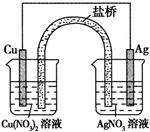
 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
|
|
|
| O | - 3 |
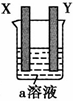
| ||
| ||
| ||
| ||


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
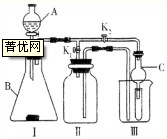
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.用托盘天平称量50.56 g氯化钾
B.用50 mL量筒量取5.0 mL稀H2SO4
C.用碱式滴定管量取18.5 mL 1 mol·L-1的NaOH溶液
D.用250 mL容量瓶配制200 mL 0.1 mol·L-1的Na2CO3溶液
E.欲在烧杯中加热配制50 mL某溶液,应选用的烧杯规格是250 mL
F.用50 mL酸式滴定管量取25 mL稀盐酸的操作是:将盐酸加入酸式滴定管使其凹液面正好与25 mL刻度相切,将溶液全部放入烧杯,可准确量取25 mL稀盐酸
G.用pH试纸检验溶液酸碱性的操作是:先取一块试纸放在表面皿或玻璃片上,用沾有待测液的玻璃棒点在试纸中部,观察颜色的改变并在半分钟内与标准比色卡对比,确定溶液的pH
(2)请选用下列试剂:酚酞、石蕊、稀氨水、氯化铵溶液、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水,设计实验证明NH3·H2O在水中存在电离平衡,请简述实验方法及现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com