
 FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。 FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有 。
CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有 。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率 (填序号)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。  CO2转化率(%) CO2转化率(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
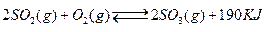
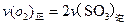 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化 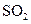 和0.10mol
和0.10mol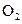 ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含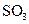 0.18mol,则
0.18mol,则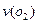 =______
=______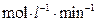 :若继续通入0.20mol
:若继续通入0.20mol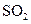 和0.10mol
和0.10mol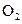 ,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(
,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(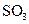 )<______mol。
)<______mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.11∶15 | B.小于11∶15 | C.5∶6 | D.大于5∶6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
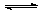 2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学方程式 | K (t1 ) | K (t2) |
  2 2 | 1.8  |  |
   |  |  |
   |  |  |
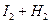  2HI 2HI | 43 | 34 |
 生成HX,用原子结构解释原因: 。
生成HX,用原子结构解释原因: 。 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。 的转化率逐渐降低
的转化率逐渐降低 与
与 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),2 s时测得C的浓度为0.6mol·L-1。下列说法正确的是
2C(g),2 s时测得C的浓度为0.6mol·L-1。下列说法正确的是| A.用物质A表示的平均反应速率为0.3mol/(L·s) |
| B.用物质B表示的平均反应速率为0.6mol/(L·s); |
| C.2 s时物质A的转化率为70% |
| D.2 s时物质B的浓度为0.7mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
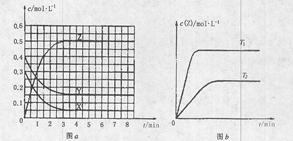
| A.该反应的正反应是放热反应 |
| B.T0时,该反应的平衡常数为1/3 |
| C.图a中反应达到平衡时,Y的转化率为37.5% |
D.反应时各物质的反应速率关系为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
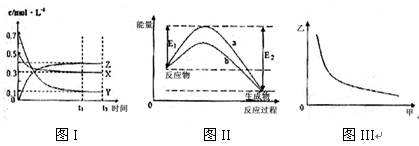

| A.该反应热化学方程式为X(g) +3Y(g) 2Z(g)△H=―(E2―E1) |
| B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 |
| C.该温度下,反应的平衡常数数值约为533。若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com