
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
②体系温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
⑦体系的密度不再变化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
【答案】B
【解析】
试题分析:①如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不变,所以不能根据压强判断反应是否达到平衡状态,错误;②体系的温度不再改变,正逆反应速率相等,所以能据此判断该反应达到平衡状态,正确;③各组分的物质的量浓度不再改变,该反应达到平衡状态,正确;④当该反应达到平衡状态,各组分的质量分数不再改变,正确;⑤当反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q时不能据此判断该反应是否达到平衡状态,错误;⑥单位时间内m mol A断键反应等效于pmol C形成,同时pmol C也断键反应,正确;⑦反应前后容积不变,气体的质量不变,则密度始终不变,所以体系的密度不再变化不能说明反应达到平衡状态,错误,答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+ 、Na+、K+。 为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,已知加热时:NH4++OH-=NH3↑+H2O,假定产生的气体全部逸出).由此可以推断原溶液组成
(1)一定存在____________可能存在______________
(2)c(CO32-)=_______________________
(3)如果上述6种离子都存在,则c(Cl-)________c(SO42-)(填>、=、<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二羟甲戊酸(如图)是生物合成青蒿素的原料之一。下列关于二羟甲戊酸的说法正确的是( )
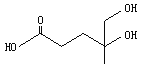
A.二羟甲戊酸的分子式为C6H10O4
B.1mol二羟甲戊酸与足量的Na钠反应生成1mol H2
C.二羟甲戊酸与乙醇、乙酸均能发生酯化反应
D.二羟甲戊酸不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是:
A. 普通硅酸盐陶瓷 B. 氮化硅陶瓷 C. 光导纤维 D. 玻璃钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl2性质的说法不正确的是
A. 是无色无味的气体
B. 不能使干燥的有色布条褪色
C. 与石灰乳反应可制得漂白粉
D. 每个分子中有1个共用电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于如图装置叙述正确的是

A. 若要除去CO中的CO2,可以装入氢氧化钠溶液,气体从b管进a管出
B. 该装置若装满水可以用于排水法收集气体
C. 该装置不可用于浓硫酸干燥H2气体
D. 用排水法收集气体时,气体从a管进b管出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内有amolA生成的同时生成3amolB;
③A、B、C的浓度不再变化;
④容积不变的密闭容器中混合气体的总压强不再变化;
⑤混合气体的物质的量不再变化;
⑥单位时间消耗amolA,同时生成3amolB ;
⑦A、B、C的分子数目之比为1:3:2。
A.②⑤ B.②⑦ C.①③ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南北朝时期炼丹家陶弘景在《陶隐居集》中记载了某种物质的鉴定分析法:“先时有人得一种物,其色理与芒硝大同小异,外观如雪,强烧之,紫青烟起,仍成灰,云是真硝石也。”这种物质是 ( )
A. KNO3 B. CuSO4·5H2O C. KMnO4 D. Na2SO4·10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
②NO能被酸性高锰酸钾氧化为NO3-。
设计制备装置如下(夹持装置略去)。

(1)装置A中用于盛放稀HNO3溶液的仪器名称为___________________;
写出装置A中发生主要反应的离子方程式 。
(2)装置D的作用为_________________。
(3)如果没有B装置,写出C中发生副反应的化学方程式①_______________、②____________。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。请设计一种提高NaNO2纯度的改进措施 。
【实脸II】测定制取的样品中NaNO2的含量
步骤:已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

(5)根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com