
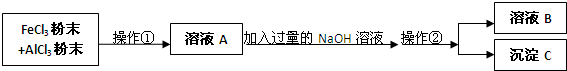
分析 AlCl3和FeCl3的混合粉末加入水溶解,在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,以此解答该题.
解答 解:AlCl3和FeCl3的混合粉末加入水溶解,在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,
(1)由以上分析可知操作①为溶解,操作②为过滤,故答案为:溶解、过滤;
(2)在溶液中加入过量氢氧化钠溶液,发生Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,过滤得到溶液B含有NaAlO2,沉淀C为Fe(OH)3,故答案为:NaAlO2;Fe(OH)3;
(3)Fe3+可与KSCN发生反应生成血红色溶液,故答案为:血红;
(4)操作②为过滤,用到的仪器有漏斗等,故答案为:漏斗;
(5)FeCl3和NaOH反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
点评 本题考查物质的分离、提纯,为高频考点和常见题型,题目综合考查元素化合物知识的理解和运用,着重于化学实验基本方法的训练和培养,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收1mol SO2就会放出5.6LCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 杂质 | 化学方程式 | |
| ① | Na2CO3溶液 | NaHCO3 | NaOH+NaHCO3=H2O+Na2CO3 |
| ② | Mg粉 | Al 粉 | 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ |
| ③ | CO2 | SO2 | SO2+2NaHCO3═Na2SO3+H2O+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:Fe2++Cl2═Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
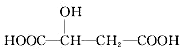 下列说法正确的是( )
下列说法正确的是( )| A. | 苹果酸分子中存在5种不同种类的氢原子 | |
| B. | 1mol苹果酸可与3mol NaOH完全中和 | |
| C. | 苹果酸与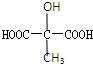 互为同分异构体 互为同分异构体 | |
| D. | 苹果酸分子中的所有碳原子可能处在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
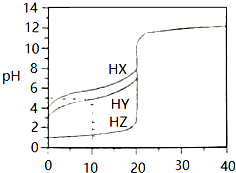 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com