
��14�֣�������̼����������ЧӦ������Ҫ���ʣ����ܼ��ţ���Ч������Դ���ܹ����ٶ�����̼���ŷš�
1.��һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2 molCO2��3mol H2�������ķ�ӦΪ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H����akJ��mol��1��a��0���� ���CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)��H2O(g)����H����akJ��mol��1��a��0���� ���CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��

����˵���÷�Ӧ�Ѵ�ƽ��״̬����________��
A��CO2����������ڻ�������б��ֲ���
B����������ƽ����Է�����������ʱ��ı仯���仯
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O
D����Ӧ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1:1���ұ��ֲ���
�����д�ʩ����ʹ �������________��ѡ���ţ���
�������________��ѡ���ţ���
A�������¶�
B�����º����³���He(g)
C����H2O(g)����ϵ�з���
D�����º����ٳ���2 mol CO2��3 mol H2
�ۼ�����¶��´˷�Ӧ��ƽ�ⳣ��K��_________�����ı����� ����ѡ�����ʹK��1��
A������ѹǿ B������Ӧ��Ũ�� C�������¶� D�������¶� E���������
��2��ij�״�ȼ�ϵ��ԭ����ͼ1��ʾ��

��M��������Ӧ�ĵ缫��ӦʽΪ______________________ _________��
���������������Դ����ͼ2װ�õ�ⱥ��ʳ��ˮ���缫��Ϊ���Ե缫������õ�ⷴӦ���ܷ�Ӧ�����ӷ���ʽΪ�� ��������Һ���Ϊ300mL������Һ��pHֵ��Ϊ13ʱ���ڳ����²ⶨ�������������ļ״�������Ϊ______________��������Һ����仯����
��3����һ����CO2�����״�ȼ�ϵķ�����
��֪��CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����b kJ��mol��1��
2H2(g)��O2(g)��2H2O(g) ��H����c kJ��mol��1��
H2O(g)��H2O(l) ��H����d kJ��mol��1��
���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ��________________________ _________��
��1����AB ��CD ��0.20��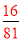 C ��2����CH3OH��6e����H2O��CO2��6H��
C ��2����CH3OH��6e����H2O��CO2��6H��
��2Cl��+2H2O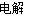 H2��+Cl2��+2 OH�� 0.16g
H2��+Cl2��+2 OH�� 0.16g
CH3OH(l) �� O2(g) ��CO2(g) ��2H2O(l) ��H������
O2(g) ��CO2(g) ��2H2O(l) ��H������ c��2d��a��b��kJ��mol��1
c��2d��a��b��kJ��mol��1
��������
�����������1����δƽ��CO2����������Ǹ��仯���������ڻ������CO2������������ֲ��䣬˵���Ѿ�ƽ���ˣ���A��ȷ��δƽ��ʱ��������ƽ����Է��������Ǹ��仯���������ڲ���ʱ��ı仯���仯��˵���Ѿ���ƽ��״̬����B��ȷ����λʱ����ÿ����1.2mol H2����������ͬʱ����0.4mol H2O��Ҳ���������ܷ�ӳ���淴Ӧ֮��Ĺ�ϵ����C����Ӧ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ��䣬����˵�����Ե���������ʱ��ı仯���仯����C���������¶ȣ�ƽ�������ƶ����ʱ�ֵ��С����A�����º����³���He��g����ƽ�ⲻ�ƶ����ʱ�ֵ���䣬��B����H2O��g������ϵ�з��룬ƽ�������ƶ����ʱ�ֵ���C��ȷ�����º����ٳ���2mol CO2��3mol H2���൱������ѹǿ��ƽ�������ƶ����ʱ�ֵ���D��ȷ��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L�� 1 1.5 0 0
�仯��mol/L�� 0.25 0.75 0.25 0.25
ƽ�⣨mol/L�� 0.75 0.75 0.25 0.25
���ԣ� K=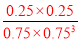 =0.20����ƽ�ⳣ�����¶ȵĺ�����ֻ��ͨ���ı��¶ȣ����ı�ƽ�ⳣ��������Ӧ�����ȷ�Ӧ�������¶ȣ�Kֵ���2����M��������������һ����Ӧ��ԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+�����ö��Ե缫����ⱥ��ʳ��ˮ�ܵĵ缫��ӦʽΪ2Cl-+2H2O
=0.20����ƽ�ⳣ�����¶ȵĺ�����ֻ��ͨ���ı��¶ȣ����ı�ƽ�ⳣ��������Ӧ�����ȷ�Ӧ�������¶ȣ�Kֵ���2����M��������������һ����Ӧ��ԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+�����ö��Ե缫����ⱥ��ʳ��ˮ�ܵĵ缫��ӦʽΪ2Cl-+2H2O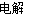 H2��+Cl2��+2OH-��pHֵ��Ϊ13ʱ��pOH=1��C��OH-��=10-1mol/L��n��OH-��=10-1mol/L��300mL��10-3L/mL=0.03mol����CH3OH-6e-+H2O=CO2+6H+��2Cl-+2H2O
H2��+Cl2��+2OH-��pHֵ��Ϊ13ʱ��pOH=1��C��OH-��=10-1mol/L��n��OH-��=10-1mol/L��300mL��10-3L/mL=0.03mol����CH3OH-6e-+H2O=CO2+6H+��2Cl-+2H2O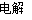 H2��+Cl2��+2OH-��֪��
H2��+Cl2��+2OH-��֪��
CH3OH �� 6e- �� 6OH-
32g 6mol
m��CH3OH�� 0.03mol
��m��CH3OH��=32g��0.03mol��6mol=0.16g��
��3��Ӧ�ø�˹���ɽ��⣬��H=-��H1-��H2+ ��H3+2��H4=-��
��H3+2��H4=-�� c+2d-a-b��kJ?mol-1������CH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH��l��+
c+2d-a-b��kJ?mol-1������CH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH��l��+ O2��g��=CO2��g��+2H2O��l����H=-��
O2��g��=CO2��g��+2H2O��l����H=-�� c+2d-a-b��kJ?mol-1��
c+2d-a-b��kJ?mol-1��
���㣺��ѧ��Ӧ�е������仯����ѧƽ�����绯ѧ


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�������ʡ�������и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ�����������ˮ�μӵ�һ����ɫʯ����ֽ�ϣ���ֽ�ϻ������ͼ��ʾ�İ뾶�����������������Բ������������ɫ��ͬ��

�����й�˵���в���ȷ����
A����ʵ�������ˮ�������ԡ�Ư����
B���ڻ��ʰ�ɫ��ʺ�ɫ��dz��ɫ
C���������ɫ�IJ�������˱仯�����У��кͷ�Ӧ��������ԭ��Ӧ��
D����ˮ���γɴ�����ķ�Ӧ�л�ԭ������HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�������ʡ˫Ѽɽ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣�ˮ�ںܶ�ķ�Ӧ�У�������Ҫ�����á���������ˮ����ķ�Ӧ���ش����⣺
�� 2F2+2H2O==4HF+O2
��2Na2O2+2H2O== 4NaOH + O2��
��2Na+2H2O==2NaOH+H2��
��2H2O 2H2��+O2��
2H2��+O2��
��1��ˮֻ������������ ������д��ţ���ͬ��ˮֻ����ԭ������ ��ˮ������������������ԭ������ ��ˮ�Ȳ������������ֲ��ǻ�ԭ����������ԭ��Ӧ�� ��
��2���������з�Ӧ�ĵ���ת�Ƶķ������Ŀ��3Cl2 +6 NaOH��5NaCl + NaClO3 + 3H2O
��3��������Ӧ3Cl2 + 6NaOH��5NaCl + NaClO3 + 3H2O��ת��5mol���ӣ�������������������ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�������ʡ˫Ѽɽ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�У�Na�� ���ʵ���Ũ��������
A��100mL 0.1mol��L-1��Na2SO4��Һ
B��100mL 0.01 mol��L-1��NaCl��Һ
C��10mL 0.1mol��L-1��NaOH��Һ
D��1mL 0.5mol��L-1��NaNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�������ʡ˫Ѽɽ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
С������ѪҺ���鵥�У�������Ϊ5.9 mmol/L����ʾ�����ָ�����������
A���ܽ��(s) B�����ʵ���Ũ��(c)
C����������(w) D��Ħ������(M)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���ຣʡ�����и�����ѧ�ڵ�һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A������FeSO4��Һ�м���˫��ˮ: 2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O
B����ⱥ��MgCl2��Һ: 2H2O + 2Cl-  H2��+Cl2��+ 2OH-
H2��+Cl2��+ 2OH-
C����Ca(ClO)2��Һ��ͨ��SO2����: Ca2+ + 2ClO- + H2O + SO2 =CaSO3��+ 2HClO
D����̼�������Һ�м�����������������Һ: Ca2+ + HCO3- + OH-=CaCO3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�������ɽ�ظ�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��10�֣����ֶ�����Ԫ�������ڱ��е����λ��������ʾ������ZԪ��ԭ�Ӻ��������������������������3������ش��������⣺
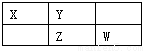
��1��Ԫ��Zλ�����ڱ��е�_______���ڣ�_______ �壻
��2����ЩԪ�ص��⻯���У�ˮ��Һ������ǿ����_______________��д��ѧʽ����
��3��XW2�ĵ���ʽΪ_______________
��4��Y������������ˮ���������⻯�ﷴӦ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�������ɽ�ظ�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ��ȷ����
A��NH4Cl�ĵ���ʽ��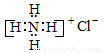
B��������Ϊ7��̼ԭ�ӣ�7C
C��Cl�������ӽṹʾ��ͼ��
D��������Ľṹʽ��H��Cl��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A�������£��������������Ļ����ҺpH=7����C(Na+)=c(CH3COO-)
B��ij�¶��£�pH=6��NaCl��Һ������Ũ�ȵĴ�С��ϵ��c(Na+)= c(Cl-)>c(H+)>c(OH-)
C����2a mol��L��1HCN��a mol��L��1 NaOH��Һ�������Ϻ�������Һ��c(Na��)>c(CN��)��������ҺpH>7
D����0.1 mol NaHCO3��0.2molNa2CO3�Ļ��Һ�У�c(Na��)��c(H��)��c(OH��)��c(HCO3��)��2c(CO32��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com