
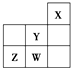
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中不正确的是( )| A、W的最高价氧化物对应的水化物是强酸 |
| B、Y的原子半径在同周期主族元素中最小 |
| C、W的非金属性比Z的强 |
| D、Z的气态氢化物的稳定性在同主族元素中最强 |


科目:高中化学 来源: 题型:
| A、无法计算 |
| B、0.015mol/L |
| C、0.011mol/L |
| D、0.045mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物的总能量一定高于生成物的总能量 |
| B、一个反应是放热还是吸热取决于该反应的发生是否需要加热 |
| C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| D、若旧键断裂吸收的总能量小于新键形成放出的总能量,则该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- |
| B、该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C、该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ |
| D、该混合液中:c(K+)≥0.2mol/L c(CO32-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 |
| B、不能用稀硝酸与锌反应制氢气--强氧化性 |
| C、要用棕色瓶盛装浓硝酸--不稳定性 |
| D、能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓H2SO4沾到皮肤上,先用干抹布擦干,再用大量水冲洗 |
| B、实验室固体物质着火可以用细沙覆盖,液体物质着火可以用湿抹布扑盖 |
| C、H2还原金属氧化物时,需要先通H2,然后检验H2纯度,再加热金属氧化物 |
| D、闻气体气味时,用手在集气瓶口轻轻扇动,让少量气体飘进鼻孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
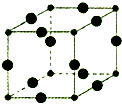 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com