
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH![]() 、SO
、SO![]() 、CO
、CO![]() 、NO
、NO![]() 。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33 g。下列说法正确的是( )
。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33 g。下列说法正确的是( )
A. 该溶液中可能含有Na+ B. 该溶液中肯定含有NH![]() 、SO
、SO![]() 、CO
、CO![]() 、NO
、NO![]()
C. 该溶液中一定不含NO![]() D. 该溶液中一定含Na+,且c(Na+)≥0.1 mol·L-1
D. 该溶液中一定含Na+,且c(Na+)≥0.1 mol·L-1
【答案】D
【解析】根据实验1:第一份加入足量的烧碱并加热,会产生气体224 mL,证明含有NH![]() ,且物质的量为0.01 mol;实验2:第二份先加入足量的盐酸,无现象,则一定不含有CO
,且物质的量为0.01 mol;实验2:第二份先加入足量的盐酸,无现象,则一定不含有CO![]() ,再加足量的BaCl2溶液,得固体2.33 g,证明一定含有SO
,再加足量的BaCl2溶液,得固体2.33 g,证明一定含有SO![]() ,且物质的量为
,且物质的量为![]() =0.01 mol,根据溶液中的电荷守恒,则一定含有钠离子,且钠离子的浓度≥
=0.01 mol,根据溶液中的电荷守恒,则一定含有钠离子,且钠离子的浓度≥![]() =0.1 mol·L-1。该溶液中一定含有Na+,故A错误;该溶液中肯定含有NH
=0.1 mol·L-1。该溶液中一定含有Na+,故A错误;该溶液中肯定含有NH![]() 、SO
、SO![]() 、Na+,故B错误;该溶液中可能含有NO,故C错误;根据溶液中NH
、Na+,故B错误;该溶液中可能含有NO,故C错误;根据溶液中NH![]() 物质的量为0.01 mol,SO
物质的量为0.01 mol,SO![]() 物质的量为0.01 mol,根据电荷守恒则c(Na+)≥0.1 mol·L-1,故D正确。故选D。
物质的量为0.01 mol,根据电荷守恒则c(Na+)≥0.1 mol·L-1,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】将碘水倒入汽油中,下列现象描述正确的是( )
A. 汽油在上层,水在下层,汽油无色
B. 汽油在下层,水在上层,汽油紫色
C. 汽油在上层,水在下层,水无色
D. 水在上层,汽油在下层,汽油紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中:
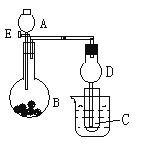
(1)若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的化学方程式: 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2)若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解。当沉淀完全溶解,恰好变澄清时,关闭E然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: 。实验结束时用 清洗银镜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是

A. 它们的一氯代物均只有三种
B. 它们之间互为同系物
C. 三星烷与乙苯互为同分异构体
D. 六星烷的化学式为C18H24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是 ( )
被提纯物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
B | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol羟基与1 mol氢氧根离子所含的质子数和电子数均为9NA
B. 1 L 0.1 mol·L-1的NaHCO3溶液中HCO![]() 、CO
、CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
C. 0.1 mol·L-1的CuCl2溶液中含有Cl-的数目为0.2NA
D. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某双原子分子构成的气体,其摩尔质量为M g·mol-1,该气体的质量为m g,阿伏加德罗常数为NA mol-1,则:
①该气体在标准状况下的体积为________ L;
②该气体在标准状况下的密度为__________g·L-1;
③该气体所含的原子总数为_________个;
④该气体的一个分子的质量为_________g。
(2)设阿伏加德罗常数为NA。如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
则CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH=_________________。
CH4(g)+2H2O(g) ΔH=_________________。
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图所示。

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由______________________________。
②M点的平衡常数Kp=_____________________。(只列算式。Kp的表达式是将平衡分压代替平衡浓度。某物质的平衡分压=总压×该物质的物质的量分数)
(3)下图表示在一定条件下的1 L的密闭容器中, X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况。下表是3 mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%)。


①X、Y、C三种气体发生反应的化学方程式为_________________________。
②表中a的取值范围是________________________________。
③根据上图和上表分析,25 min~40 min内图中曲线发生变化的原因可能是________。
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。
H2CO3 | H2SO3 | HNO2 | HClO |
K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3、②HNO2、③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com