
某溶液可能含Cl-、CO32-、SO42-、Na+,现取少量溶液滴入硝酸酸化,无明显现象,再滴入氯化钡溶液,有白色沉淀生成,取上层清液滴加硝酸银溶液,产生白色沉淀。下列判断不合理的是
A. 一定有Cl- B. 一定有Na+
C. 一定无CO32- D. 一定有SO42-
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:简答题
汽车尾气的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4KJ/mol
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3,在低温下能否自发进行,并说明理由_________。
(2)已知TiO2催化尾气降解原理为:
2CO(g)+O2(g)  2CO2(g);
2CO2(g);
2H2O(g)+4NO(g)+O2(g)  4HNO3(g)。
4HNO3(g)。
Ⅰ.在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示( ),反应40秒后检测气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因______________。
),反应40秒后检测气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因______________。
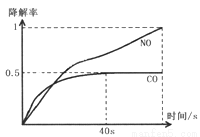
Ⅱ.图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化,回答谢列问题:

①已知50℃、t秒时容器中O2浓度为0.01mol/L,求此温度下CO降解反应的平衡常数_______。
②下列关于图2的叙述不正确的是_______
A.根据降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10-60℃范围内进行实验,请在图2中用线段与阴影仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例: )。_______
)。_______
(3)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1L1mol·L-1的CH3COONa溶液中微粒数目等于2NA
B. 1molCnH2n+2中含有的共价键数为(3n+1)NA
C. 常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D. 标准状况下,8.0gSO3含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
下列说法正确的是
A. HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B. 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C. 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
D. 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为2CaCO3+O2+2SO22CaSO3+2CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1molCl2参加的任何反应,反应过程中转移电子数都是2NA
B. 标准状况下,11.2L乙醇所含的羟基数为0.5NA
C. 常温常压下,17g甲基(—14CH3)所含的中子数为9NA
D. 室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。现用该浓硫酸配制450mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。

请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
(2)经计算,配制上述稀硫酸时需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数)。
(3)接下来的操作是将上述所取浓硫酸进行稀释,稀释的操作是________________、__________________。
(4)在溶液配制过程中,下列操作会引起所配置硫酸的浓度偏低的有_________(填序号)
A.用量筒量取浓硫酸读数时仰视刻度线;
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒;
C.浓硫酸稀释后未经冷却即转移到容量瓶中;
D.容量瓶未干燥就用来配置溶液;
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平;
F.定容时仰视刻度线。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 28g N2所含有的原子数为NA
B. 标准状况下,22.4 L水中含有的水分子数为NA
C. 500 mL 1.0 mol/L碳酸钠溶液中所含Na+的数为0.5NA
D. 49g纯硫酸所含有的氧原子数与标况下22.4L CO2中所含有的氧原子数相等
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是
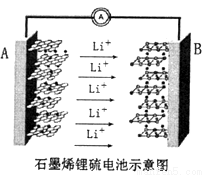
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-=Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com