
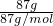 ═1mol,在MnO2+4HCl?MnCl2+Cl2↑+2H2O中,每有1mol二氧化锰反应,就会有4molHCl反应,而氯元素化合价发生变化生成氯气的HCl只有2mol,据此可知:1molMnO2完全反应被氧化的氯化氢的物质的量是2mol.
═1mol,在MnO2+4HCl?MnCl2+Cl2↑+2H2O中,每有1mol二氧化锰反应,就会有4molHCl反应,而氯元素化合价发生变化生成氯气的HCl只有2mol,据此可知:1molMnO2完全反应被氧化的氯化氢的物质的量是2mol.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室用二氧化锰和浓盐酸制取氯气:MnO2+4HCl
| ||||
B、铜与稀硝酸反应:Cu+4H++2N
| ||||
C、向氯化铝溶液中通入过量氨气:A13++4OH-?A1
| ||||
D、向Ca(OH)2溶液中加入过量NaHCO3溶液:Ca2++2HC
|
查看答案和解析>>
科目:高中化学 来源: 题型:
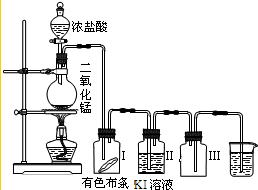 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:
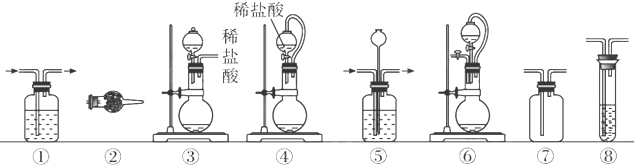
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com