
 .
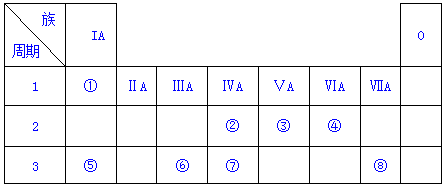
. 分析 根据元素在周期表中的位置知,①-⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;
(3)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,则为NaOH.
解答 解:根据元素在周期表中的位置知,①-⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Na、Al原子有3个电子层,O原子有2个电子层,且Al原子序数大于Na,所以④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强,②、③、⑦非金属性强弱顺序是N>C>Si,所以其最高价氧化物的水化物酸性强弱顺序是HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,则为NaOH,NaOH的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表和元素周期律综合应用,明确元素周期表结构、物质结构及原子结构是解本题关键,知道非金属性强弱判断方法,知道非金属性强弱与其最高价氧化物的水化物酸性关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 | |
| B. | 葡萄糖溶液中加入新制Cu(OH)2悬浊液煮沸会析出红色沉淀 | |
| C. | 氨基酸有两性,其脱水缩合得到的蛋白质就不再有两性 | |
| D. | 纤维素、淀粉都可用(C6H10O5)n表示,但它们并不为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式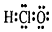 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com