
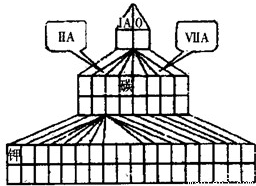
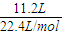 =0.5mol,故C的价电子数为
=0.5mol,故C的价电子数为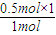 =1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素.
=1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素.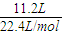 =0.5mol,故C的价电子数为
=0.5mol,故C的价电子数为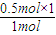 =1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素,
=1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素, ,故答案为:
,故答案为: ;
;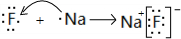 ,故答案为:
,故答案为: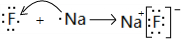 ;
;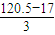 =35.5,为Cl元素,该化合物为NCl3,分子中N原子与Cl原子之间形成1对共用电子对,则该物质的结构式为
=35.5,为Cl元素,该化合物为NCl3,分子中N原子与Cl原子之间形成1对共用电子对,则该物质的结构式为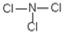 ,
,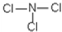 .
.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com