
| 阳离子 | K+、NH4+、H+、Ba2+ |
| 阴离子 | Cl-、CO32-、SO42-、OH- |
 NH3↑+H2O
NH3↑+H2O NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.

科目:高中化学 来源:不详 题型:单选题
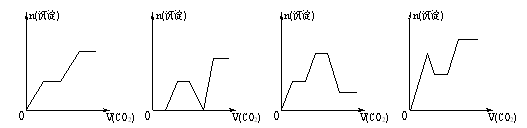
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Al3+ | C.Fe2+ | D.Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- |
| B.钠与水的反应:Na+2H2O=Na++2OH-+H2↑ |
| C.铜片跟稀硝酸的反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
| D.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 回答下列问题:
回答下列问题: (1) 试分析原溶液中一定含有的离子是 ,一定不含有的离子是
(1) 试分析原溶液中一定含有的离子是 ,一定不含有的离子是  (2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”) ,
(2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”) , 并说明理由 。
并说明理由 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入稀硝酸后,再加入AgNO3溶液,有白色沉淀生成,则说明原溶液中含有Cl- |
| B.加入KSCN溶液无红色出现,再加入氯水溶液变血红色,说明原溶液中一定含有Fe2+ |
| C.加入用稀硝酸酸化的Ba(NO3)2溶液产生白色沉淀,则可推断原溶液中一定含有SO42- |
| D.加入盐酸产生使澄清石灰水变浑浊的无色无味的气体,可推测原溶液中含有CO32-离子或HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是 HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com