
分析 (1)足量的NaHCO3溶液中滴入少量的Ca(OH)2,氢氧根离子完全反应,则二者反应生成碳酸钙、碳酸钠和水;
(2)Ba(OH)2溶液中,逐滴加入NaHSO4溶液,硫酸氢钠少量全反应,氢氧根应剩余,溶液是碱性的,继续滴加NaHSO4溶液发生氢离子与氢氧根离子的反应.
解答 解:(1)足量的NaHCO3溶液中滴入少量的Ca(OH)2,氢氧根离子完全反应,则二者反应生成碳酸钙、碳酸钠和水,离子方程式为2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-,
故答案为:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-;
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液,硫酸氢钠相对于氢氧化钡量少,所以硫酸氢钠全反应,即Ba2++OH-+H++SO42-=BaSO4↓+H2O;
溶液中剩余氢氧根离子,在以上溶液中继续滴加NaHSO4溶液,发生氢离子与氢氧根离子的反应,离子方程式为:OH-+H+=H2O;
故答案为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;OH-+H+=H2O.
点评 本题考查离子反应的书写,为高频考点,把握发生的化学反应为解答的关键,注意电子、电荷守恒及离子反应中保留化学式的物质,注意这两个反应产物还与反应物的量有关,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
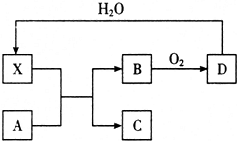 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )| A. | X能使蔗糖变黑主要体现了 X的强氧化性 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | 若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生 | |
| D. | 工业上,B转化为D的反应需使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是在原子、分子水平上研究物质的组成、结构、性质、制备等的自然科学 | |
| B. | 化学是一门具有创造性的科学,可以利用化学知识创造出自然界中不存在的物质 | |
| C. | 化学的发展经过了从宏观到微观,从感性到理性的逐步深化的过程 | |
| D. | 随着化学的发展,人们最终会实现通过化学变化使水变油的梦想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 乙酸乙酯、硝基苯的制备、银镜反应实验均需要水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
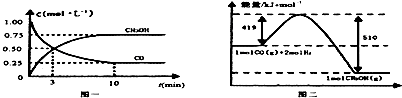
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治疗胃酸过多,可用NaHCO3,不能用Al(OH)3,因其含有Al元素 | |
| B. | Al箔用砂纸打磨后,在空气中受热可以熔化,由于氧化膜被破坏,熔化的Al可以滴落 | |
| C. | 用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用 | |
| D. | 实验室制备Al(OH)3时,氨水不宜过量,因为Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com