
����Ŀ����������(SOCl2)�����Ȼ���������һ��Һ̬�ķǵ���ʣ��е�Ϊ77�棬SOCl2����Ԫ������Ԫ��ֱ���Թ��ۼ�����������C1��-1��, SOCl2��ˮ�����ҷ�Ӧ��Һ�����������γɣ����д��̼�����ζ�������ݳ����������ʹƷ����Һ��ɫ�����Ⱥ���ɫ�ָ�����ش��������⣺
I.����MgCl2��Һ���ܵõ���ˮMgCl2������SOC12��MgCl2��6H2O��ϲ����ȣ����Ƶ���ˮMgCl2������SOC12��ˮ��Ӧ�ķ���ʽ�ͱ�Ҫ����������ԭ��____________��
II. ��1 L 0.1 mol��L-1��Ba(OH)3��Һ�е���SOCl2��ʼʱ������ɫ��������������SOCl2���������ְ�ɫ�������ܽ⡣
(1)���ְ�ɫ��������ӷ���ʽΪ__________________��
(2)��ɫ�����ܽ�����з�����Ӧ��BaSO3+ H+==Ba2++HSO3-����������ȫ�ܽ�ʱ�����Һ��pH=3�����Ե���SOCl2�����������Һ�е�c(HSO3-)=_______��(H2SO4: Ka1=1.5��10-5��Ka2=1.0��10-7��BaSO3:Kap=5.0��10-7)
III.��ҵ�ϣ����������������·�Ӧ�Ƶã�
i.SO3(g)+SCl2(g) ![]() SOCl2(g)+SO2(g) ��H1=+302 kJ��mol-1
SOCl2(g)+SO2(g) ��H1=+302 kJ��mol-1
ii.SO2(g)+PCl5(g) ![]() SOCl2(g)+POCl3(g) ��H2=-268kJ��mol-1
SOCl2(g)+POCl3(g) ��H2=-268kJ��mol-1
(1)��֪�������л�ѧ���ļ������±���ʾ��

�����x=________________��
(2)��1 L�ݻ��㶨���ܱ������г���1.0molPCl5(g)��1.0mol SO3(g)��1.0 mol SCl2(g),��������������Ӧ��������������ʱ����ϵ��SO2��ƽ������������¶�(T)�Ĺ�ϵ��ͼ��ʾ��

�������¶ȵ����ߣ�SO2��ƽ��������������ԭ��Ϊ_________��
��T1��ʱ�����ƽ����ϵ��SO3�����ʵ���Ϊ0.2 mol������¶���,PCl5��ƽ��ת����Ϊ______����ӦI��ƽ�ⳣ����ֵΪ__________��
���𰸡� SOCl2+H2O==SO2��+2HCl������SOCl2��ͨ�룬�ܹ�����MgCl2 6H2O�ֽ������ˮ��ͬʱ���ɵ�HCl������ MgCl2��ˮ�� Ba2++4OH-+SOCl2==BaSO3��+2Cl-+2H2O 0.05 mol��L-1 362 ��ӦiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ�������������ӦiiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ���������Ҳ���� 20% 15
�����������������������Ҫ���黯ѧƽ�⡣
I.����MgCl2��Һ���ܵõ���ˮMgCl2������SOC12��MgCl2��6H2O��ϲ����ȣ����Ƶ���ˮMgCl2��������ΪSOCl2+H2O==SO2��+2HCl������SOCl2��ͨ�룬�ܹ�����MgCl2 6H2O�ֽ������ˮ��ͬʱ���ɵ�HCl������ MgCl2��ˮ�⡣
II. (1)���ְ�ɫ��������ӷ���ʽΪBa2++4OH-+SOCl2==BaSO3��+2Cl-+2H2O��
(2) BaSO3:Kap=5.0��10-7=c(Ba2+)c(SO32-), c(Ba2+)= c[Ba(OH)3)]= 0.1 mol��L-1���ɵ�c(SO32-)= 5.0��10-6 mol��L-1��
Ka2=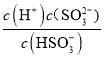 =1.0��10-7����c(SO32-)= 5.0��10-6mol��L-1��c(H+)=1��10-3 mol��L-1����ɵ�
=1.0��10-7����c(SO32-)= 5.0��10-6mol��L-1��c(H+)=1��10-3 mol��L-1����ɵ�
c(HSO3-)=0.05 mol��L-1 ��
III.(1) ��H2=��Ӧ�����֮��-���������֮��=(364��2+331��5-585-320��3-382-2x) kJ��mol-1
=-268kJ��mol-1��x=362��
(2)�������¶ȵ����ߣ�SO2��ƽ��������������ԭ��Ϊ����ӦiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ�������������ӦiiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ���������Ҳ����
��T1��ʱ����ʼ����1.0mol SO3(g)�����ƽ����ϵ��SO3�����ʵ���Ϊ0.2 mol����ͼ��֪ƽ����ϵ��SO2�����ʵ���Ϊ3mol��20%=0.6mol��
i.SO3(g)+SCl2(g) ![]() SOCl2(g)+SO2(g)
SOCl2(g)+SO2(g)
��ʼ���ʵ���/mol 1.0 1.0 0 0
�仯���ʵ���/mol 0.8 0.8 0.8 0.8
ƽ�����ʵ���/mol 0.2 0.2 0.8 0.8
ii.SO2(g)+PCl5(g) ![]() SOCl2(g)+POCl3(g)
SOCl2(g)+POCl3(g)
��ʼ���ʵ���/mol 0.8 1.0 0 0
�仯���ʵ���/mol 0.2 0.2 0.2 0.2
ƽ�����ʵ���/mol 0.6 0.8 0.2 0.2
����¶���,PCl5��ƽ��ת����Ϊ20%��
��Ӧi��iiͬʱ����ƽ��ʱ��SO3��SCl2��SOCl2��SO2��Ũ�ȷֱ���0.2mol/L��0.2mol/L��1.0mol/L��0.6mol/L��ƽ�ⳣ����ֵΪ(1.0��0.6)/(0.2��0.2)=15.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵����,��������� ��
A. SiO2�����õİ뵼����� B. SO2������Ư��ֽ��
C. Na2O2������DZˮͧO2��Դ D. Cl2����������������Ư��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4���ǻ��㶹�أ��Ǻϳ�ҩ�����Ҫ�м��壬�������ϳ�;�����£�

��֪����F�Ľṹ��ʽΪ ��
��
�� ( X=O��N��S��R����)��
( X=O��N��S��R����)��
��RCOOR+2R��OH��R��COOR��+2ROH
�ص��������⣺
(1)����4���ǻ��㶹�ص�˵����ȷ����____________��(����ĸ)
a.��ʹ��ˮ��ɫ b.1mol �������������4mol NaOH��Ӧ
c.�����������9��̼ԭ�ӹ�ƽ�� d.���ڱ���ͬϵ��
(2)A����B�ķ�Ӧ����Ϊ__________��D�Ľṹ��ʽΪ__________��
(3)I������Ϊ_______________��
(4)д��G����H�Ļ�ѧ����ʽ________________________��
(5)������������������F���ṹ��ʽ����֪����ͬ���칹�����Ŀ��__________�֣�
a.�ܷ���������Ӧ b.���ڱ��Ķ�ȡ���� c.ֻ����һ����
д������ͬ���칹������ʹFeCl3��Һ����ɫ���˴Ź���������������������Ϊ1:2:2:2:1�Ľṹ��ʽ______________��
(6)�������֪ʶ����Ϣ�����������ϳ�·�ߣ��Ա���Ϊ��ʼԭ��(���Լ���ѡ)����Ʊ� �ĺϳ�·��______________��
�ĺϳ�·��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2015���㶫]��nAΪ�����ӵ���������ֵ������˵����ȷ����
A��23 g Na������H2O��Ӧ��ȫ�������nA��H2����
B��1 mol Cu��������Ũ���ᷴӦ������nA��SO3����
C����״������22.4 L N2��H2������к�nA��ԭ��
D��3 mol����Fe��ȫת��ΪFe3O4��ʧȥ8nA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������ʼ���;��˵����ȷ����(����)
A. �Ҵ��������Na��Ӧ
B. ��������NaHCO3��Һ��Ӧ
C. ��ϩ����Ҫ��ʯ�ͻ�����Ʒ
D. ���³�ѹ�������顢��ϩ������������Ϊ��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ����������������Y��Zλ��ͬ���ڡ��ס��ҡ���������ЩԪ����ɵĶ�Ԫ����� 0.001 molL-1 �ļ���ҺpHΪ3�����Ǿ���Ư���ԵĻ����������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ��� ��

A. ԭ�Ӱ뾶Z��Y��X
B. ����������Ԫ�ع��ɵ���Һ���ܳ����ԡ����Ի�����
C. ��Ϊ�ɼ��Լ����ɵķǼ��Է���
D. ��ΪһԪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ���ܴ��������һ�������ǣ� ��
A��NH4+��Ba2+��Br����CO32�� B��Cl����SO32����Fe2+��H+
C��K+��Na+��SO42����MnO4�� D��Na+��H+��NO3����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. Ũ�������ǿ�����ԣ��ʲ�����������������Ũ����
B. �����������������ʹƷ����Һ��ɫ
C. Ư�۱�¶�ڿ����о��û����
D. ���������£�þ���ڶ�����̼������ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���(����ʽΪC13H18O2)��һ��ʳƷ���ϣ���ϳ�·������ͼ��ʾ��

ͨ���������A����Է�������Ϊ56�����ĺ˴Ź���������ʾ��������ҷ����֮��Ϊ1��3��D�����к���֧����F�����к��б���������E�ɷ���������Ӧ���ڴ���������1molE��2 molH2���Է�����Ӧ����F����ش�
(1)A�Ļ�ѧ����Ϊ__________ ��B�����������ŵ�����Ϊ________��E�Ľṹ��ʽΪ________��
(2)C������Cu(OH)2����Һ��Ӧ�����ӷ���ʽΪ________________________________��
(3)D��F��Ӧ�Ļ�ѧ����ʽΪ_______________________���䷴Ӧ������_____________��
(4)д����������������F��ͬ���칹��_______________________________��д�����е�һ�ּ��ɣ�F���⣩
����FeCl3��Һ����ɫ���ں˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ1��2��3��6��
��5������������(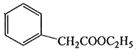 )��һ����Ҫ��ҽҩ�м��塣д���Ա���ͪ��
)��һ����Ҫ��ҽҩ�м��塣д���Ա���ͪ��![]() �����Ҵ�Ϊ��Ҫԭ���Ʊ������������ĺϳ�·������ͼ�����Լ���ѡ����
�����Ҵ�Ϊ��Ҫԭ���Ʊ������������ĺϳ�·������ͼ�����Լ���ѡ����
�ϳ�·������ͼ��ο�������ʽ��
![]() __________________________________________________
__________________________________________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com