
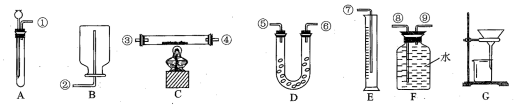
分析 利用锌与稀硫酸反应生成氢气,并通过排水法测定生成的氢气的体积来计算混合物中的锌的量,从而测定该样品中锌的质量分数,所以选择的仪器连接顺序为①⑨⑧⑦,据此分析解答;
(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;
(3)根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(4)称取a g黄铜粉末样品进行实验,测定生成H2的体积b L(折算为标准状况),计算生成氢气物质的量得到合金中锌的物质的量,计算得到质量分数.
解答 解:(1)要想分离铜和锌,只能根据两种金属的活泼性不同,使活泼金属和酸反应,另一种金属和酸不反应,不仅能将两种金属分开,还能根据反应计算锌的质量,则实验时必须用到的化学试剂为稀硫酸,
故答案为:稀硫酸;
(2)选用的实验装置AEF,根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:AFE,装置接口处的编号表示连接顺序为①⑨⑧⑦,
故答案为:AEF; ①⑨⑧⑦;
(3)称取a g黄铜粉末样品进行实验,实验中你测定的其他有效数据是生成H2的体积b L(已折算为标准状况),故选A,故答案为:A;
(4)称取a g黄铜粉末样品进行实验,实验中你测定的其他有效数据是生成H2的体积b L(已折算为标准状况),Zn+H2SO4=ZnSO4+H2↑,生成氢气物质的量n=$\frac{bL}{22.4L/mol}$=$\frac{b}{22.4}$mol,
合金中锌的质量分数=$\frac{\frac{b}{22.4}mol×65g/mol}{ag}$×100%=$\frac{65b}{22.4a}$×100%,
故答案为:$\frac{65b}{22.4a}$×100%.
点评 本题考查了探究物质的组成或含量的测定,题目难度中等,明确测量原理是解本题关键,注意掌握化学实验基本操作方法及综合应用,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
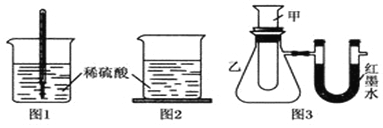
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
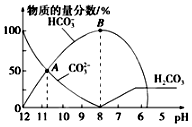 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
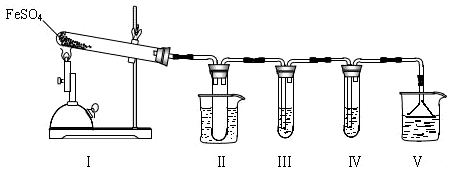
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | B. | HF的电子式: | ||
| C. | 8个中子的碳原子的核素符号:12C | D. | CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气不导电,属于非电解质 | |
| B. | 乙酸是有机物,属于非电解质 | |
| C. | 在水溶液和熔融状态下都能够导电的物质才属于电解质 | |
| D. | KCl和Al2O3在熔融状态下均导电,都属于电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com