
由乙烯推测丙烯(CH2=CH-CH3)与溴水反应时,下列反应产物正确的是 ( )
A.CH2Br-CH2-CH2Br B.CH3-CBr2-CH3
C.CH3-CH2-CHBr2 D.CH3-CHBr-CH2Br
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:实验题
马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:①CH3CH2CN CH3CH2COOH
CH3CH2COOH
②F的结构简式:
以下是该有机物F的合成路线,请填写下列空白。
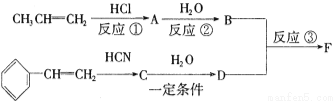
(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出与D互为同分异构体,结构中含有苯环且苯环上含有一个乙基(苯环上的取代基处于对位)的酯类的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
下列有关电解质溶液的叙述正确的是
A.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2c(CO32-)
B.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,不断增大
C.室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中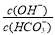 增大
增大
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考训练四理综化学试卷(解析版) 题型:选择题
化学与我们的生活息息相关。下列说法不正确的是( )
①油脂的皂化可看作取代反应②碘盐补的碘是碘酸钾,AD钙奶补钙的钙是钙离子,含铁酱油补铁的铁是铁离子③计算机芯片的硅由自然界的硅提纯而来④棉花和合成纤维的主要成分都是纤维素⑤生活中用的铝壶比较耐腐蚀,是因为铝是不活泼金属⑥淀粉水解生成葡萄糖放出热量,提供生命活动的能量
A.①③④⑤ B.②③④⑤ C.①③④⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:选择题
某实验室需要少量的一氯乙烷,下列制取方法中所得产物含量最高的是( )
A.等物质的量的乙烷和氯气的光照反应 B.乙烯与氯气的加成反应
C.乙烯与氢气和氯气的混和气体反应 D.乙烯与氯化氢加成反应
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:填空题
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
②NaH2PO2为___________(填“正盐”或“酸式盐”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:选择题
用Pt电极电解含有Ag+、Cu2+和X3+各0.1mol的溶液,阴极析出固体物质的质量与回路中通过电子的物质的量的关系如图所示.则下列氧化性强弱的判断正确的是
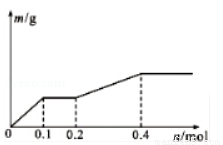
A.Ag+>X3+>Cu2+>H+>X2+ B.Ag+>Cu2+>X3+>H+>X2+
C.Cu2+>X3+>Ag+>X2+>H+ D.Cu2+>Ag+>X3+>H+>X2+
查看答案和解析>>
科目:高中化学 来源:2016届湖北省师大一附高三5月月考理综化学试卷(解析版) 题型:填空题
2015年,中国药学家屠哟坳获得诺贝尔生理学和医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素。青蒿素是从黄花篙中提取得到的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素。请回答下列问题:
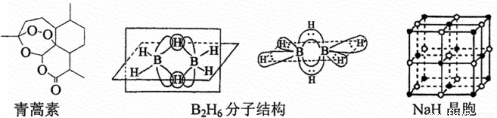
(1)组成青蒿素的三种元素电负性由大到小排序是_________,画出基态O原子的价电子排布图_________。(2)一个青蒿素分子中含有_________个手性碳原子;
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素。硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4 4NaH+BF3=NaBH4+3NaF
①写出BH4-的等电子体_________ (分子、离子各写一种);
②1976年,美国科学家利普斯康姆(W.N.Lipscomb)因提出多中心键的理论解释B2H6的结构而获得了诺贝尔化学奖。B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子。则B2H6分子中有_________种共价键,B原子的杂化方式为_________。
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是_________。
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比 =_________。
=_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键 B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体 E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
(6) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com