
现有三种常见治疗胃病药品的标签:

药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( )
A.①=②=③ B.①>②>③
C.③>②>① D.②>③>①
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:实验题
某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
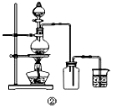
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。
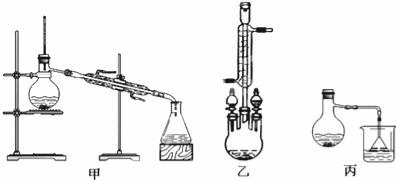
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。
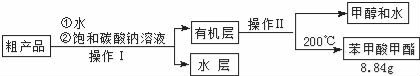
(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:实验题
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%。回答问题:
2F+D,F中的E元素的质量分数为60%。回答问题:
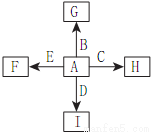
(1)①中反应的化学方程式为____________。
(2)1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_________克。
(3)C与过量NaOH溶液反应的离子方程式为________,反应后的溶液与过量的化合物I反应生成沉淀的离子方程式为____________。
(4)E与I反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
下列有关实验装置、操作,不能实现相应实验目的的是( )
A | B | C | D | |
装置 |
|
|
|
|
目的 | 用NaOH溶液除去溴苯中单质溴 | 证明浓硫酸有脱水性、强氧化性 | 确定Ksp(AgCl)、Ksp(AgI)的相对大小 | 观察水能否全部流下判断装置气密性 |
查看答案和解析>>
科目:高中化学 来源:2016届江西省、临川二中高三下联考理综化学试卷(解析版) 题型:实验题
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为____。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是____。
查看答案和解析>>
科目:高中化学 来源:2016届江西省、临川二中高三下联考理综化学试卷(解析版) 题型:选择题
对下图的实验装置和操作评价不合理的是( )
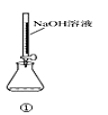
选项 | 装置和操作 | 评价 |
A | 用装置①量取15.00ml的NaOH溶液 | 错误:不能用酸式滴定管,应改用碱式滴定管 |
B | 用装置②制备Cl2 | 错误:氯气密度大于空气,收集时导管应长进短出 |
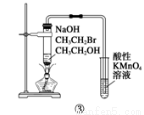
C | 用装置③验证溴乙烷发生消去反应生成烯烃 | 正确:生成的乙烯可使高锰酸钾褪色 |
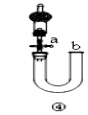
D | 关闭活塞a,从b处加水,以检查装置④的气密性 | 正确:b处加水后,左右液面形成稳定的高度差,证明气密性良好 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省六安市高三下综合训练十理综化学试卷(解析版) 题型:实验题
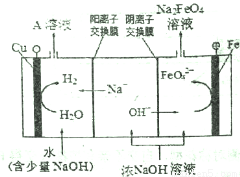
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,不会造成二次污染。
己知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
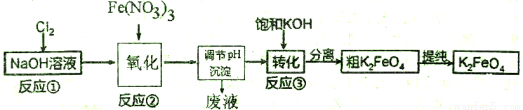
(1)①上述氧化过程中,发生反应的离子方程式是__________,在实际生产中一般控制反应温度30℃以下,其原因是__________。
②沉淀过程中加入浓KOH溶液可析出高铁酸钾(K2FeO4 ),这说明__________。
③在提纯K2FeO4中采用重结晶、洗涤、低温烘干的方法,沉淀洗涤方法是__________。
④某温度下,将C12通入NaOH溶液中,反应后得到NaCl,NaC1O,NaClO3的混合溶液,经测定ClO-与C1O3-离子的物质的量之比是1: 2,则C12与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为__________。
(2)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为__________,其中可循环使用的物质是__________。
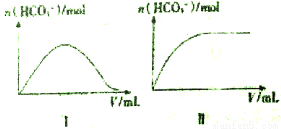
(3)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3②HNO3③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下期中化学试卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是 。C60和金刚石都是碳的同素异形体,二者比较,熔点高的是 。
(2)A、B均为短周期金属元素,依据下表数据,写出B的基态原子的电子排布式 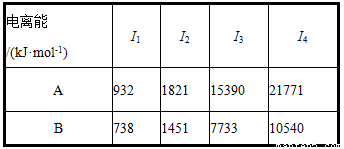
过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色。如[Co(H2O)6]2+显粉红色。据此判断,
[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
②配合物Fe(CO)5的配体是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com