
| A. | 它们所含氧原子数目之比为2:3 | B. | 它们的体积之比为1:1 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的分子数目之比为1:1 |
分析 6.4gSO2的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,8.0gSO3的物质的量为$\frac{8.0g}{80g/mol}$=0.1mol,根据V=nVm结合分子的组成分析.
解答 解:6.4gSO2的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,8.0gSO3的物质的量为$\frac{8.0g}{80g/mol}$=0.1mol,
A.它们所含氧原子数目之比为0.1mol×2:0.1mol×3=2:3,故A正确;
B.相同状况下,气体的体积比等于物质的量之比,但是SO3不一定是气体,所以它们的体积之比无法判断,故B错误;
C.它们所含氧原子数目之比为0.1mol×30.1mol×4=3:4,故C正确;
D.物质的量之比等于分子式之比,所以它们的分子数目之比为1:1,故D正确.
故选B.
点评 本题考查了物质的量的计算,明确物质的量的有关公式中各个物理量之间的关系式是解本题关键,注意气体摩尔体积的适用范围及适用条件,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用CaCO3固体与稀盐酸制取CO2,多倒出的CaCO3固体不能再放回原试剂瓶 | |
| B. | H2还原灼热的氧化铜时,点燃酒精灯前必须先检验H2的纯度 | |
| C. | 含硫酸铜的废液倒入水槽,用水冲入下水道 | |
| D. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性、金属离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属元素在不同化合物中的化合价都相同 | |
| D. | 金属元素的单质在常温下都呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
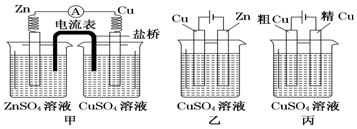
| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有明显变化 |
| ② | B+D | 有无色、无味气体生成 |
| ③ | B+C | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
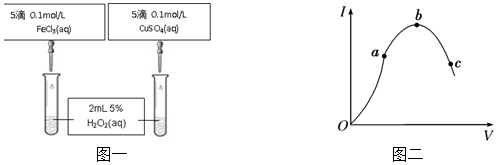
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
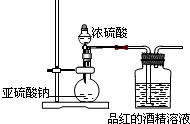
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com