
【题目】下列反应的离子方程式正确的是 ( )
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是 ( )
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
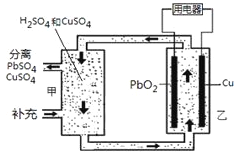
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是ZrSiO4,还含有少量A12O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:

(1)SiCl4的电子式为__________。上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是___________________________________________________。
(2)高温气化后的固体残渣除C外,还含有的金属元素有________
(3)写出上述流程中ZrCl4与水反应的化学方程式:_____________________。
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆、二氧化锆的叙述中,正确的是_____(填序号)。
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆。写出电解的总反应方程式并标明
电子转移的方向和数目 _________________________________________________。
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为_____________________。
(7)极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1,则该溶液中溶质的pc=5。下列说法正确的是_____
A.电解质溶液的pc(H+)与pc(OH﹣)之和均为14
B.用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大
C.BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小
D.某温度下Ksp(Zr(CO3)2)=4.0×10﹣12,则其饱和溶液中pc(Zr4+)+ pc(CO32﹣)=7.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i. CH3OH(g) ![]() CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO(g)+ 2H2(g) △H =+90kJ·mol-1
ii. CO(g)+H2O(g)![]() CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”)。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(P)的关系如图2所示。
①P1、P2、P3由大到小的顺序为___________________。
②测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
Ⅱ.现有HA、HB 和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
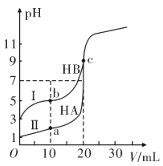
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为_____________________________;
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
① 若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C 的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)可循环使用的物质是______。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________。
(2) 检验CaO2·8H2O是否洗净的操作是________。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaHCO3的知识填空。
(1)NaHCO3俗名_________。
(2)NaHCO3水溶液中滴入酚酞后,溶液呈_________色。
(3)NaHCO3与盐酸反应的离子方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )

A. 在阴极室,发生的电极反应为2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO+2H+![]() Cr2O+H2O向右移动
Cr2O+H2O向右移动
C. 该制备过程中总反应的化学方程式为4K2CrO4+4H2O=2K2Cr2O7+4KOH+2H2↑+O2↑
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值。下列说法正确的是( )
A. 1molNa2O2固体中含离子总数为4 NA
B. 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
C. 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA
D. 常温下,1mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com