
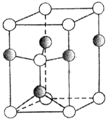
 ���ڱ���ǰ36��Ԫ��A��B��C��D��E��F��G��H������ԭ������������������B��C��Dԭ�Ӿ�����ͬ�ܲ�����A��Eͬһ���壬D��Gͬһ���壬E��F��H�dz�������Ԫ�أ�A��B�γɻ�������һ���������壬DԪ��ԭ�������������Ǵ�����������3����FԪ�ص����Ӱ뾶��ͬһ�����γɼ���������С�ģ�Hԭ�ӻ�̬d�ܼ�����������P�ܼ�����������4����ش��������⣺
���ڱ���ǰ36��Ԫ��A��B��C��D��E��F��G��H������ԭ������������������B��C��Dԭ�Ӿ�����ͬ�ܲ�����A��Eͬһ���壬D��Gͬһ���壬E��F��H�dz�������Ԫ�أ�A��B�γɻ�������һ���������壬DԪ��ԭ�������������Ǵ�����������3����FԪ�ص����Ӱ뾶��ͬһ�����γɼ���������С�ģ�Hԭ�ӻ�̬d�ܼ�����������P�ܼ�����������4����ش��������⣺ ���ǽ�����Խǿ����һ������Խ��N��2p���Ӱ�����Ϊ�ȶ��ṹ�����һ��������С�����˳����Al��C��O��N���ʴ�Ϊ��
���ǽ�����Խǿ����һ������Խ��N��2p���Ӱ�����Ϊ�ȶ��ṹ�����һ��������С�����˳����Al��C��O��N���ʴ�Ϊ�� ��Al��C��O��N��
��Al��C��O��N��| 5-2��2 |
| 2 |
| 10-12 |
| 10-5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȷ�Ӧ�ķ�Ӧ�������Ǵ������ȷ�Ӧ�ķ�Ӧ���� |
| B��2A��g��+B��g��=C��I�����Է����У���÷�Ӧ�ġ�H��0 |
| C�������ȼ����Ϊ-890.3kJ?mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��?CO2��g��+2H2O��g����H=-890.3KJ?mol |
| D����֪N2��g��+3H2��g��?2NH3��g����H=-akJ?mol-1����1molN2��3molH2��ַ�Ӧ�����շ���С��akJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������Է����� |
| B�����������Է����� |
| C���κ��¶��¶������Է����� |
| D���κ��¶��¶����Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-890.3KJ/mol | ||||
| B��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-890.3KJ/mol | ||||
C��
| ||||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��Cu��Fe |
| B��Fe��Cu |
| C��Fe��O |
| D��Fe��S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��Na��Mg��Al |
| B�����ȶ��ԣ�HCl��H2S��PH3 |
| C������ǿ����H4SiO4��H2CO3��CH3COOH |
| D���۵㣺���ʯ��ʳ�Σ��ɱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ں�Fe2+����Һ�У�Cl-��S2-��K+��I- |
| B����c��H+��=0.01 mol?L-1����Һ�У�Cu2+��Br-��SO42-��NH4+ |
| C����ʹ���ȳʺ�ɫ����Һ�У�Mg2+��Cl-��S2O32-��Na+ |
| D������ɫ��Һ�У�Cr2O72-��K+��H+��CH3OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʾ�����Ǹս�����NaCl��Һ��ʯ����ֽ��A��B��ͭƬͨ���������ӵ�Դ��������ͭƬ�����ֽ�ϵ�һ��KMnO4��Һ��ͨ��һ��ʱ�����AB��������Ϻ�ɫԲ����A���ƶ���һ�ξ��룬����A�������ǵ�Դ��
��ͼ��ʾ�����Ǹս�����NaCl��Һ��ʯ����ֽ��A��B��ͭƬͨ���������ӵ�Դ��������ͭƬ�����ֽ�ϵ�һ��KMnO4��Һ��ͨ��һ��ʱ�����AB��������Ϻ�ɫԲ����A���ƶ���һ�ξ��룬����A�������ǵ�Դ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
131 53 |
131 53 |
| A��������Ϊ131 |
| B��������Ϊ53 |
| C��������Ϊ78 |
| D�����������Ϊ131 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com