
| A、SO42-、HCO3-、Na+、H+ |
| B、K+、SO42-、Fe3+、NO3- |
| C、H+、Na+、Cl-、CO32- |
| D、Ca2+、OH-、CO32-、Na+ |


科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1NA 个CO32-的Na2CO3固体的质量为10.6g |
| B、含1mol 溶质的盐酸溶液与足量Fe反应,消耗NA个Fe原子 |
| C、0.1mol?L-1的稀硫酸中含有SO42-个数为0.1NA |
| D、标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V2=10V1 |
| B、V1>10V2 |
| C、V2<10V1 |
| D、V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化除了热量外还可以是光能、电能等 |
| B、需要加热才能进行的化学反应一定是吸热反应 |
| C、化学反应过程中的能量变化服从能量守恒定律 |
| D、生成物的总能量小于反应物的总能量时发生的是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、氯气和冷水反应:Cl2+H2O═2H++Cl-+ClO- |
| C、铝和烧碱溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、148g/mol |
| B、24g/mol |
| C、74g/mol |
| D、40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
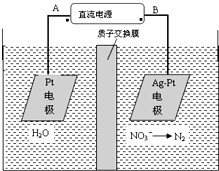 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.下列说法不正确的是( )| A、A为电源正极 |
| B、阳极反应式为:2H2O-4e-═4H++O2↑ |
| C、若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为10.4克 |
| D、阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com