
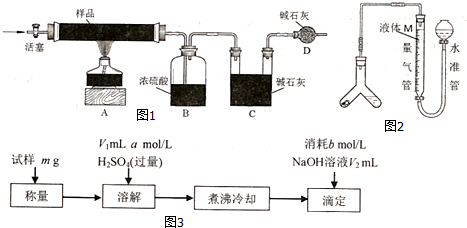
分析 方案一:加热样品分解为CuO、二氧化碳与水,根据B中浓硫酸溶液增重测定生成水的质量,根据C中碱石灰增重测定生成二氧化碳的质量,D中碱石灰吸收空气中二氧化碳与水蒸气,防止加进入C中,根据硬质玻璃管中最终剩余固体为CuO,计算各自物质的量,根据原子守恒可以计算氢氧化铜、碳酸铜的物质的量,进而确定化学式;
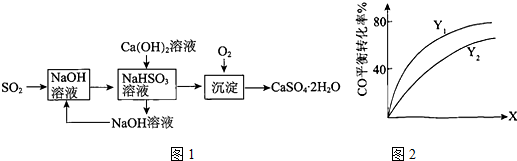
方案二:(4)利用排M液态测定二氧化碳的体积,则二氧化碳在M溶液中溶解性要小;
(5)a.CO2气体中含有水蒸气,测定二氧化碳的体积偏大;
b.测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大;
c.Y型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量;
d.测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小;
方案三:硫酸与碱式碳酸铜反应生成硫酸铜与二氧化碳,煮沸赶出溶液中溶解的二氧化碳,再用氢氧化钠溶液滴定剩余的硫酸,可以计算参加反应硫酸物质的量,铜离子物质的量与消耗硫酸的物质的量相等,结合碱式碳酸铜的质量,列方程计算氢氧化铜、碳酸铜的物质的量,进而取得化学式,如果在滴定中加入氢氧化钠过量,会生成氢氧化铜沉淀,导致测定剩余硫酸物质的量偏大,消耗硫酸偏小,则沉淀Cu质量偏小,而碳酸铜中Cu的质量分数小于氢氧化铜中Cu的质量分数,则沉淀碳酸铜的含量偏高.
解答 解:方案一:加热样品分解为CuO、二氧化碳与水,根据B中浓硫酸溶液增重测定生成水的质量,根据C中碱石灰增重测定生成二氧化碳的质量,D中碱石灰吸收空气中二氧化碳与水蒸气,防止加进入C中,根据硬质玻璃管中最终剩余固体为CuO,计算各自物质的量,根据原子守恒可以计算氢氧化铜、碳酸铜的物质的量,进而确定化学式.
(1)加热完毕再通一段时间氮气的作用是:将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收,
故答案为:将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收;
(2)图1中装置D的作用是:防止装置C吸收空气中的水蒸气和二氧化碳,影响测定结果,
故答案为:防止装置C吸收空气中的水蒸气和二氧化碳,影响测定结果;
(3)B装置增重0.900g,则生成水为$\frac{0.9g}{18g/mol}$=0.05mol
C装置增重3.300g,则生成二氧化碳为$\frac{3.3g}{44g/mol}$=0.075mol,
由原子守恒可知,碱式碳酸铜中氢氧化铜为0.05mol,碳酸铜为0.075mol,则1:x=0.05mol:0.075mol,解得x=1.5,
故答案为:1.5;
方案二:(4)为了减小实验误差,量气管中液体M的选择原则是:二氧化碳在M溶液中溶解度要小,
故答案为:二氧化碳在M溶液中溶解度要小;
(5)a.CO2气体中含有水蒸气,测定二氧化碳的体积偏大,测得该式样中x值偏高,故a不符合;
b.测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大,测得该式样中x值偏高,故b不符合;
c.Y型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量,故c不符合;
d.测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小,则测得该式样中x值偏低,故d符合,
故选:d;
方案三:硫酸与碱式碳酸铜反应生成硫酸铜与二氧化碳,煮沸赶出溶液中溶解的二氧化碳,再用氢氧化钠溶液滴定剩余的硫酸,可以计算参加反应硫酸物质的量,铜离子物质的量与消耗硫酸的物质的量相等,结合碱式碳酸铜的质量,列方程计算氢氧化铜、碳酸铜的物质的量,进而取得化学式.
(6)用氢氧化钠滴定剩余硫酸时,溶解在溶液中的二氧化碳能与氢氧化钠溶液反应,使测定剩余的硫酸偏大,故加热煮沸的目的:将生成的二氧化碳全部赶出,避免影响滴定结果,
故答案为:将生成的二氧化碳全部赶出,避免影响滴定结果;
(7)如果在滴定中加入氢氧化钠过量,会生成氢氧化铜沉淀,导致测定剩余硫酸物质的量偏大,消耗硫酸偏小,则沉淀Cu质量偏小,而碳酸铜中Cu的质量分数小于氢氧化铜中Cu的质量分数,则沉淀碳酸铜的含量偏大,
故答案为:偏大.
点评 本题考查物质组成测定,属于并列型题目,解题的关键在于理解实验方案的原理,是对学生分析计算能力的综合考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | A2>B2>C2>D2 | B. | D2>C2>B2>A2 | C. | B2>C2>A2>D2 | D. | C2>A2>B2>D2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOCH=CH2 | B. | CH3CH2COOCH2CH2CH3 | ||
| C. | CH2=CHCH2COOCH2CH2CH=CH2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
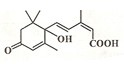 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 1mol该物质可消耗2molNaOH | ||
| C. | 分子式为C14H20O4 | D. | 1mol该物质可与3molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3-CH2-CH3 | B. | CH2=CHCH2CH3 | C. | CH3C=CCH2CH3 | D. | 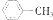 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com