
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
分析 由每1mol分别完全燃烧时的热量,$\frac{Q}{M}$越小时,相同质量的燃料,完全燃烧时放出热量越少,以此来解答.
解答 解:C2H5OH、CH4、C3H8、C各1mol分别完全燃烧时,放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ,
则$\frac{1366.8}{46}$=29.71、$\frac{890.6}{16}$=55.66、$\frac{2219.9}{44}$=50.45、$\frac{393.5}{12}$=32.79中,只有29.71最小,可知相同质量的这四种燃料,完全燃烧时放出热量最少的是C2H5OH,
故选A.
点评 本题考查热化学反应,为高频考点,把握反应中能量变化、燃烧热的应用为解答的关键,侧重分析与应用能力的考查,注意单位质量与物质的量的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中:Na+.K+.AlO2-.CO32- | |
| B. | 在含大量Fe3+的溶液中:NH4+.Na+.Cl-.SCN- | |
| C. | 在c(H+)=10-13mol/L 的溶液中:NH4+.Al3+.SO42-.NO3- | |
| D. | 在pH=1的溶液中:K+.Fe2+.Cl-.NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
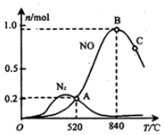 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
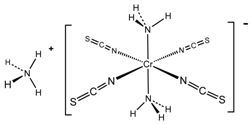
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 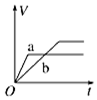 | B. | 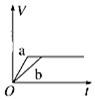 | C. | 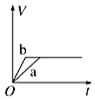 | D. | 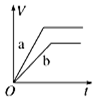 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
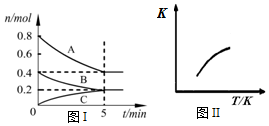 固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )| A. | 200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol•L-1•min-1 | |
| B. | 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆) | |
| C. | 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| D. | 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com