
【题目】氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、金属铋生产中,副产品 NaBiO3可作测定锰的氧化剂。工业上常用辉铋矿(主要成分是Bi2S3,还含有少量SiO2等杂质),制备BiOCl和NaBiO3(二者都难溶于水),其流程如下:
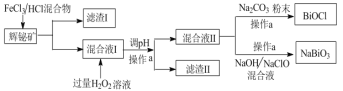
(1)操作a使用的玻璃仪器是_____________,工业上制备HCl的反应原理是:_____。
(2)滤渣I中的成分为________,分离滤渣I中的成分的物理方法是:__________。
(3)请从平衡角度解释调pH产生滤渣Ⅱ的原因:__。
(4)混合液 II 中加入 Na2CO3粉末,当混合液Ⅱ中____________(填实验现象)时,说明BiOCl的生成已完成。混合液II中加入NaOH和NaClO发生的离子方程式________。
(5)加入 H2O2发生反应的离子方程式_______,过滤后,如何洗涤BiOCl固体_______。
【答案】玻璃棒、烧杯、漏斗 H2+Cl2![]() 2HCl SiO2、S 升华 溶液中存在平衡:Fe3++3H2O
2HCl SiO2、S 升华 溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀 不再产生气泡; Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O 2Fe2++H2O2+2H+===2Fe3+2H2O 向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次
Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀 不再产生气泡; Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O 2Fe2++H2O2+2H+===2Fe3+2H2O 向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次
【解析】
向辉铋矿中加入氯化铁溶液和盐酸,氯化铁与Bi2S3发生氧化还原反应生成氯化铋、氯化亚铁和硫单质,SiO2不反应,过滤,得到滤渣为SiO2和S,滤液中含有Bi3+、H+、Fe2+;向滤液中加入双氧水,双氧水将亚铁离子氧化为三价铁离子,加入加入适量 Bi2O3调节溶液pH,将三价铁离子转化为氢氧化铁沉淀除去,过滤,得到含有Bi3+的滤液;向含有Bi3+的滤液中加入碳酸钠粉末促进Bi3+水解,使Bi3+转化为BiOCl沉淀;向含有Bi3+的滤液中加入氢氧化钠和次氯酸钠混合液,次氯酸钠与Bi3+在碱性条件下发生氧化还原反应生成NaBiO3沉淀。
(1)操作a为过滤,过滤用到的玻璃仪器有玻璃棒、烧杯、漏斗;工业上用氢气在氯气中燃烧制备HCl,反应的化学方程式为H2+Cl2![]() 2HCl,故答案为:玻璃棒、烧杯、漏斗;H2+Cl2
2HCl,故答案为:玻璃棒、烧杯、漏斗;H2+Cl2![]() 2HCl;
2HCl;
(2)向辉铋矿中加入氯化铁溶液和盐酸,氯化铁与Bi2S3发生氧化还原反应生成氯化铋、氯化亚铁和硫单质,SiO2不反应,过滤,得到滤渣I为SiO2和S,二氧化硅是原子晶体,溶沸点高,而硫是分子晶体,受热易升华,则可以用加热升华的方法分离二氧化硅和硫,故答案为:SiO2、S;升华;
(3)氯化铁在溶液中水解,存在溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量Bi2O3,Bi2O3与 H+反应,使溶液中c(H+)减小,水解平衡向正反应方向移动,产生Fe(OH)3沉淀,从而达到除去铁元素的目的,故答案为:溶液中存在平衡:Fe3++3H2O
Fe(OH)3+3H+,加入适量Bi2O3,Bi2O3与 H+反应,使溶液中c(H+)减小,水解平衡向正反应方向移动,产生Fe(OH)3沉淀,从而达到除去铁元素的目的,故答案为:溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀;
Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀;
(4)氯化铋在溶液中水解使溶液呈酸性,加入碳酸钠粉末,碳酸钠与氢离子反应生成氯化钠、二氧化碳和水,促进Bi3+水解,使Bi3+转化为BiOCl沉淀,当不再产生气泡是,说明BiOCl的生成已完成;向混合液II中加入NaOH和NaClO混合溶液,次氯酸钠与Bi3+在碱性条件下发生氧化还原反应生成NaBiO3沉淀,反应的离子方程式为Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O,故答案为:不再产生气泡;Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O;
(5)加入双氧水的目的是在酸性条件下将亚铁离子氧化为三价铁离子,便于调节溶液pH,将三价铁离子转化为氢氧化铁沉淀除去,反应的离子方程式为2Fe2++H2O2+2H+===2Fe3+2H2O;洗涤沉淀的方法是向过滤器中注入蒸馏水至恰好浸没固体,待水自然流出后,重复操作2~3 次即可,故答案为:2Fe2++H2O2+2H+===2Fe3+2H2O;向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次。


科目:高中化学 来源: 题型:
【题目】有机物的种类繁多,包含烃和烃的衍生物,官能团决定有机物的化学性质,请按要求回答下列问题。
I.已知乙二醇( ![]() )、丙三醇(
)、丙三醇(![]() )都与乙醇含有相同的官能团,都属于醇类物质,与乙醇具有相似的化学性质。
)都与乙醇含有相同的官能团,都属于醇类物质,与乙醇具有相似的化学性质。
请按要求完成下列问题:
(1)写出醇类物质都含有的官能团的电子式_______________。
(2)乙醇、乙二醇( ![]() )、丙三醇(
)、丙三醇(![]() )别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为______。
)别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为______。
(3)写出乙醇的催化氧化的化学方程式__________,反应类型:________ ;
(4)丙三醇(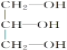 )与足量乙酸发生酯化反应的化学方程式(反应条件与乙醇酯化反应相同)_____。
)与足量乙酸发生酯化反应的化学方程式(反应条件与乙醇酯化反应相同)_____。
II.以下是用苯作原料制备一系列化合物的转化关系图,已知:R-NO2![]() R-NH2(其中-R代表烃基)
R-NH2(其中-R代表烃基)
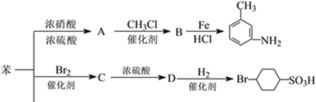
(5)写出A→B的化学反应方程式______,反应类型:_________。
(6)C中含有的官能团的名称为________;D的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
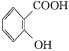
【题目】阿司匹林(乙酰水杨酸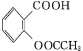 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
 +(CH3CO)2O
+(CH3CO)2O![]()
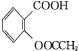 +CH3COOH
+CH3COOH
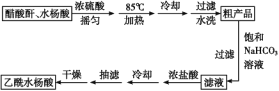
制备基本操作流程如下:
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
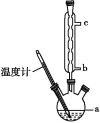
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知:
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______
(2)镁铝合金生活中应用广泛。取样品a克,溶于200mL5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_____,向反应后溶液中加入4mol/L NaOH溶液____mL,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mLO2后,可完全被H2O吸收,无气体剩余。则生成的NO为_________mL;向反应后溶液加足量的NaOH溶液,得到沉淀的质量____________ g。(用含a的代数式表示)
(4)如图所示,A,F为石墨电极,B,E为铁片电极。按要求回答下列问题。
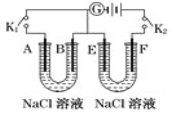
①打开K2,闭合K1,B为____极, A的电极反应式为:_________________________。
②打开K1,闭合K2,E为_____极,F极的电极反应式为:______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济与低碳技术日益受到世界各国的关注,近年来人们尝试用CO2来合成各种有机物,以下是利用CO2合成一种不饱和内酯的反应方程式:

(1)写出CO2的结构式__________;“-R”的结构简式为____________;
(2)上述反应的反应类型为_______;若3分子R-C≡C-R也可发生类似反应,则生成有机物的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
①质子数相同的粒子一定属于同种元素 ②同位素的物理性质有较大差别而化学性质几乎完全相同 ③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定 ④电子数相同的粒子不一定是同一种元素 ⑤每种元素都有两种或两种以的核素
A.①②④⑤B.③④⑤C.②③⑤D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验序 号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为______,b为______。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_______。
③硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-。在实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因:_________。
(2)工业上常用空气催化氧化法除去电石渣浆(含 CaO)上清液中的S2-,并制取石膏(CaSO42H2O),其中的物质转化过程如图所示。

①过程Ⅰ、Ⅱ中,起催化剂作用的物质是_________。
②过程Ⅱ中,反应的离子方程式为________。
③根据物质转化过程,若将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com