
CO是常见的化学物质,有关其性质和应用的研究如下。
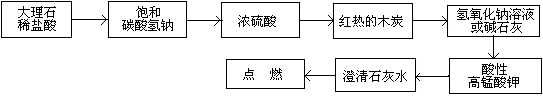
(1)有同学认为CO可以被酸性高锰酸钾溶液氧化为CO2,请你设计实验验证该同学的猜想是否正确。请在下列流程图方框内填上所需药品的名称或化学式,从而补齐你的设计,方框不够可以补,也可以不填满。
(2)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。五羰基合铁的制备原理如下:
Fe(s)+5CO(g) Fe(CO)5(g)
Fe(CO)5(g)
①下列说法正确的是 。
A.利用上述反应原理可制备高纯铁
B.制备Fe(CO)5应在隔绝空气的条件下进行
C.反应Fe(s)+5CO(g) 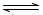 Fe(CO)5(g)的平衡常数表达式为
Fe(CO)5(g)的平衡常数表达式为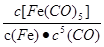
D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存
②五羰基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为: .
③今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液完全燃烧,得到30.58gCO2、
5.4gH2O及1.6g红棕色粉末。红棕色粉末的化学式为 ,照射后的溶液中Fe(CO)5和Fe2 (CO)9的物质的量之比为 .
(1)
(2)①ABD ②Fe(CO)5+4NaOH=Na2Fe(CO)4+Na2CO3+2H2O ③Fe2O3; 2∶1
【解析】
试题分析:大理石和盐酸发生反应产生二氧化碳气体。由于盐酸有挥发性,产生的二氧化碳气体中含有HCl气体和水蒸气,要先用饱和的碳酸氢钠溶液来除去HCl杂质,然后再用浓硫酸来干燥。将得到纯净的二氧化碳气体。通过灼热的木炭,二者反应氧化还原反应产生CO。用氢氧化钠溶液或碱石灰除去未反应的过量的CO2气体,将CO通入到酸性高锰酸钾溶液中,若CO可以被酸性高锰酸钾溶液氧化为CO2,会看到酸性高锰酸钾溶液的紫色褪色。用澄清的石灰水来检验并除去气体CO2,最后点燃未完全反应的CO气体,防止污染大气。(2)①A.该反应是可逆反应,利用该反应可以使固态的铁与CO反应产生液态的五羰基合铁[Fe(CO)5],使固态铁粉中的杂质过滤除去。正确。B.由于[Fe(CO)5],熔点—20.5℃,沸点103℃,光照时生成Fe2(CO)9,60℃发生自燃。所以反应要在在隔绝空气的条件下进行,以防止[Fe(CO)5]、CO及Fe的氧化和燃烧。正确。C.在该实验状态下Fe是固态,所以反应达到化学平衡时的平衡常数是K=C [Fe(CO)5]/C5(CO). 错误。D.由于[Fe(CO)5]的熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度比水大,为1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。因此Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。正确。选项为:ABD。②五羰基合铁能与氢氧化钠溶液反应的化学方程式为:Fe(CO)5+4NaOH=Na2Fe(CO)4+Na2CO3+2H2O。③根据质量守恒定律可知该红棕色粉末是Fe2O3,2[Fe(CO)5]= Fe2(CO)9+CO。n(Fe2O3)=1.6g÷160g/mol=0.01mol, n(Fe)=0.02mol. n(C)= 30.58g÷44g/mol=0.695mol.n(H2O)= 5.4g÷18g/mol=0.3mol,n(H)=0.6mol.因为在苯C6H6中碳原子核氢原子个数比为1:1,所以含铁化合物中含有的碳元素的物质的量为0.695mol-0.6mol=0.095mol。假设[Fe(CO)5]、Fe2(CO)9的物质的量分别为:X、Y,则X+2Y=0.02; 5X +9Y=0.095。联立求解。解得X=0.01;Y=0.005.所以X:Y=2:1.
考点:考查常见的化学物质CO的性质和应用的知识。


科目:高中化学 来源: 题型:
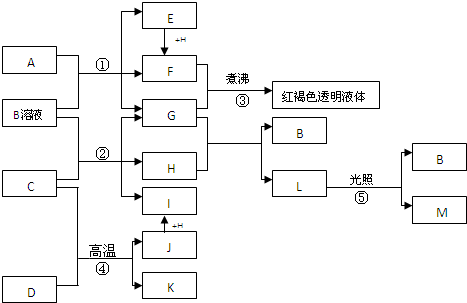
查看答案和解析>>
科目:高中化学 来源: 题型:




| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| 烃的化学式 | n(CO)/n(CO2) |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第1期 总第157期 人教课标版 题型:058
(创新)同学们,你们爱吃巧克力吗?你们是否知道,在巧克力中含有一种常见的化学物质——草酸(化学式为C2H2O4).草酸通常以晶体(C2H2O4·2H2O)的形式存在,常温下为固体.以下是某化学兴趣小组提取了草酸晶体之后对其进行研究的过程.
[提出问题]草酸晶体受热分解产生了什么?
[猜想与假设]根据质量守恒定律,草酸晶体分解的产物中可能含水、CO或CO2.
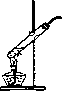
[实验论证]研究小组设计了以下实验装置(如图)对上述猜想进行了探究.

信息提示:装置B为干燥管,其中的无水硫酸铜与水反应会变成蓝色.
(1)装置A中饱和澄清石灰水的作用是________;
(2)若分解产物中存在CO,则装置C中的实验现象是________,该反应的化学方程式为________;
(3)装置E的作用是________.
[反思与评价]
(1)该实验装置在设计上存在一个明显的错误,请你将其指出:________,可以改进的方法是________;
(2)用于草酸晶体分解的实验发生装置如图所示,由此可以推断草酸晶体的一条物理性质是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com