
| A. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| B. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| C. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
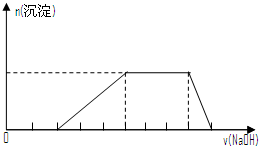
| D. | 某溶液中可能含有H+、Na+、NH${\;}_{4}^{+}$、Mg2+、Fe3+、Al3+、SO${\;}_{4}^{2-}$等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH${\;}_{4}^{+}$、Mg2+、Al3+ |
分析 A.溶液中加入一定量盐酸恰好完全反应,所得溶液为氯化钠,最后所得固体为氯化钠,根据钠离子守恒由
n(NaCl)=n(Na+),根据n=cV计算钠离子的物质的量,再根据=m=nM计算氯化钠的质量;
B.硫酸恰好完全反应,反应后的溶液中滴加KSCN不显红色,且无固体剩余物,最后为硫酸亚铁溶液,根据硫酸根守恒可知n(FeSO4)=n(H2SO4),再根据n=cV计算硫酸的物质的量;
C.开始投入1molN2和3molH2,氮气与氢气按1:3反应二者转化率相同,平衡时氮气与氢气物质的量浓度为1:3;
D.开始加入NaOH没有沉淀和气体产生,则一定有H+,后来有沉淀产生且最后消失,则一定没有Mg2+、
Fe3+,一定有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则有NH4+,根据电荷守恒可知一定有SO42-.
解答 解:A.溶液中加入一定量盐酸恰好完全反应,所得溶液为氯化钠,最后所得固体为氯化钠,根据钠离子守恒由n(NaCl)=n(Na+)=0.1L×1mol/L=0.1mol,故氯化钠的质量为0.1mol×58.5g/mol=5.85g,故A错误;
B.硫酸恰好完全反应,反应后的溶液中滴加KSCN不显红色,且无固体剩余物,最后为硫酸亚铁溶液,根据硫酸根守恒可知n(FeSO4)=n(H2SO4)=4.0mol/L×0.2L=0.8mol,故B正确;
C.开始投入1molN2和3molH2,氮气与氢气按1:3反应二者转化率相同,平衡时氮气与氢气物质的量浓度为1:3,不可能相等,故C错误;
D.开始加入NaOH没有沉淀和气体产生,则一定有H+,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则有NH4+,根据电荷守恒可知一定有SO42-,故D错误;
故选B.
点评 考查混合物的有关计算、离子反应、化学平衡有关计算等,综合性较大,难度中等,A与B清楚反应过程是解答的关键,利用守恒进行解答,根据根据反应过程解答不可取.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
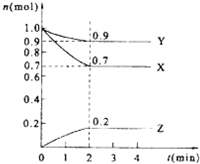 某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+SO42- Cl- | B. | Cu2+ Al3+ Cl-SO42- | ||
| C. | Fe2+NO3-Cl-CO32- | D. | Ag+ Na+NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com